
能够使合成氨反应进行的程度增大的措施是( )
A.升高温度 B.降低压强 C.使用催化剂 D.不断移去NH3
 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
如图所示装置,可用来制取和观察Fe(OH)2在空气中被氧化的颜色变化。实验时必须使用铁屑和6 mol/L的硫酸,其他试剂任选。
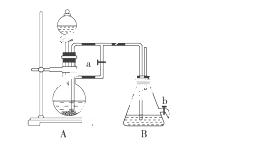
填写下列空白:
(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是________,A中反应的离子方程式是__________________________________。
(2)实验开始时应先将活塞a________(填“打开”或“关闭”)。
(3)简述生成Fe(OH)2的操作过程:________________________________________________。
(4)实验完毕,打开b处活塞,放入一部分空气,此时B中发生反应的化学方程式为________________________________________________________________________。
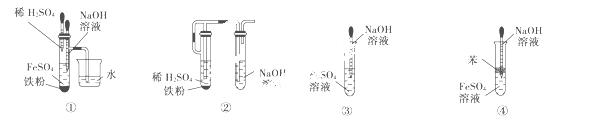
(5)下图中________能较长时间看到Fe(OH)2白色沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学探究SO2有关性质。
(1)将SO2通入BaCl2溶液中,将所得溶液分成2份,在第一份中加入NaOH溶液,在第二份中滴入FeCl3溶液,两份都有白色沉淀。BaCl2溶液中通入SO2气体的现象为 ▲ 。在第二份溶液中滴入FeCl3溶液时,SO2表现 ▲ 性,反应的离子方程式为 ▲ ,生成沉淀的化学式为 ▲ 。
(2)下列不能用来吸收SO2气体的是 ▲ 。
A.KMnO4(aq) B.过量氨水 C.石灰水 D.盐酸
(3)工业废气含SO2为7%(体积分数),在同温同压下,将以上废气用废气中的O2氧化含SO3。反应后气体体积为原来气体的96.64%。则SO2的转化率为 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
第三代混合动力车,可以用电动机、内燃机或二者结合作为动力。汽车在刹车或下坡时,电池处于充电状态。混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。下图是镍氢电池充放电原理的示意图,其总反应式为H2+2NiOOH 2Ni(OH)2。下列说法中正确的是( )
2Ni(OH)2。下列说法中正确的是( )
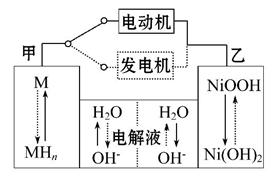
A.混合动力车上坡或加速时,溶液中的OH-向乙电极移动
B.混合动力车刹车或下坡时,乙电极周围溶液的pH增大
C.混合动力车上坡或加速时,乙电极的电极反应式为NiOOH+H2O+e-====
Ni(OH)2+OH-
D.混合动力车刹车或下坡时,甲电极的电极反应式为 H2+2OH-+2e-====2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
关于工业合成氨的叙述中,错误的是( )
A.在动力、设备、材料允许的情况下,反应尽可能在高压下进行
B.温度越高越有利于工业合成氨
C.在工业合成氨中N2、H2的循环利用可提高其利用率,降低成本
D.及时从反应体系中分离出氨气有利于平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积相同的密闭容器中,分别充入等量的氮气和氢气,在不同温度下发生反应:N2(g)+3H2(g)
 2NH3(g),并分别在不同的时间内测定其中NH3的质量分数(y轴所表示的),绘成图象如图所示,请回答:
2NH3(g),并分别在不同的时间内测定其中NH3的质量分数(y轴所表示的),绘成图象如图所示,请回答:
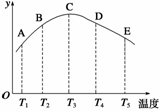
(1)A、B、C、D、E五点中,肯定未达平衡的点是
________________________________________________________________________。
(2)此可逆反应的正反应是__________热反应。
(3)AC曲线是增函数曲线,CE曲线是减函数曲线,试从化学反应速率和化学平衡的角度分析,并说明理由
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
与[H+]·[OH-]=KW类似,FeS饱和溶液中存在:FeS(s)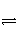
 Fe2+(aq)+S2-(aq),[Fe2+]·[S2-]=Ksp。常温下Ksp=8.1×10-17 mol2·L-2。
Fe2+(aq)+S2-(aq),[Fe2+]·[S2-]=Ksp。常温下Ksp=8.1×10-17 mol2·L-2。
(1)理论上FeS的溶解度为________________,而事实上其溶解度远大于这个数值,其原因可能是________________________________________________________________________
________________________________________________________________________。
(2)又知FeS饱和溶液中[H+]与[S2-]之间存在以下限量关系:[H+]2·[S2-]=1.0×10-22 mol3·L-3,为了使溶液中[Fe2+]达到1 mol·L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的[H+]为________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
物质的量浓度相同的①氨水、②氯化铵、③碳酸氢铵、④硫酸氢铵、⑤硫酸铵5种溶液中[NH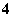 ]的大小顺序是____________________,溶液pH的大小顺序是________________________________________________________________________。
]的大小顺序是____________________,溶液pH的大小顺序是________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com