
A、B、C、D、E都是短周期的主族元素,原子序数依次增大,A、B处于同周期,C、D、E同处另一周期,C、A可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙,D是地壳中含量最高的金属元素,E的最高价氧化物对应的水化物是酸性最强的含氧酸。回答下列问题:
(1)B和E分别对应的氢化物的化学式为HB、HE,氢化物的沸点HB HE(填“>”、“<”、“=”,下同) ,氢化物的稳定性HB HE。
(2)物质乙的电子式为 ;物质乙可用于呼吸面具作供氧剂,写出乙与CO2反应的化学方程式:____________________________ 。
(3)元素C的最高价氧化物对应水化物和D的简单阳离子按照物质的量之比为7︰2在水溶液中反应的离子方程式:______________________________。
(4)1 mol 单质B的气体与1 mol C的氢氧化物在一定条件下恰好完全反应,生成一种盐、水及另一种气体,则所得气体的化学式为:___________。
科目:高中化学 来源:2017届河北省高三上期中化学试卷(解析版) 题型:选择题
亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等, 其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。某温度下,部分含
其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。某温度下,部分含 氯组分含量随pH变化情况如图所示,下列说法不正确的是
氯组分含量随pH变化情况如图所示,下列说法不正确的是
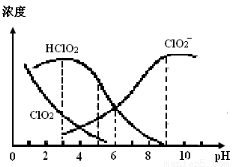
A.使用该漂白剂的适宜pH约为5.0
B.该温度下NaClO2溶液中:c(Na+)>c(ClO2-)>c(OH-)>c(H+)
C.该温度下HClO2的电离平衡常数的数值Ka≈1.0×10-6
D.不同pH的NaClO2溶液中存在下列关系:c(Na+)= c(ClO2-)+ c(HClO2)+ c(ClO2)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上11月考试化学卷(解析版) 题型:填空题
(1)已知反应 2HI(g) H2(g)+I2(g)的 ΔH=+11kJ/mol, 1mol H2(g)、 1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为_________kJ。
H2(g)+I2(g)的 ΔH=+11kJ/mol, 1mol H2(g)、 1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为_________kJ。
(2)Bodensteins 研究了下列反应:2HI(g)  H2(g)+I2(g)在 716 K 时,气体混合物中碘化氢的物质的量分数 x(HI)与反应时间 t 的关系如下表:
H2(g)+I2(g)在 716 K 时,气体混合物中碘化氢的物质的量分数 x(HI)与反应时间 t 的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为__________。
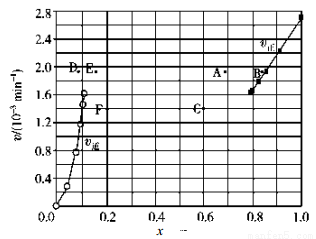
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为__________(以K和k正表示)。若 k正=0.0027 min-1,在 t=40min 时,v正=_________ min-1。
③由上述实验数据计算得到v正~x(HI)和 v逆~x(H2)的关系如图所示。当升高到某一温度时,反应重新达到平衡,相应的点依次为__________(填字母)和__________(填字母)。
查看答案和解析>>
科目:高中化学 来源:2017届重庆八中高三上学期定时训练14化学试卷(解析版) 题型:选择题
下列叙述正确的是( )
A.使用催化剂能够降低化学反应的反应热(△H)
B.金属发生吸氧腐蚀时,被腐蚀的速率和氧气浓度无关
C.原电池中发生的反应达到平衡时,该电池仍有电流产生
D.在同浓度的盐酸中,ZnS可溶CuS不溶,说明CuS的溶解度比ZnS小
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三上第四次月考化学卷(解析版) 题型:选择题
已知C3N4晶体可能具有比金刚石还大的硬度,且原子间均以单键结合,下列说法正确的是
A.C3N4晶体中C-N共价键的键长比金刚石中的C-C共价键的键长要长
B.C3N4晶体与SiO2晶体类型一致,二近都有较高的熔沸点
C.C3N4晶体中每个C原子连接3个N原子,每个N原子连接4个C原子
D.C3N4晶体中除了有共价键外还有范徳华力
查看答案和解析>>
科目:高中化学 来源:2017届山东省东营市高三上期中化学卷(解析版) 题型:选择题
向足量H2SO4溶液中加入100 mL 0.4 mol·L-1 Ba(OH)2溶液,放出的热量是5.12 kJ。如果向足量Ba(OH)2溶液中加入100 mL 0.4 mol·L-1盐酸时,放出的热量为2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为( )。
A.Ba2+(aq)+SO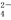 (aq)===BaSO4(s) ΔH=-2.92 kJ·mol-1
(aq)===BaSO4(s) ΔH=-2.92 kJ·mol-1
B.Ba2+(aq)+SO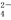 (aq)===BaSO4(s) ΔH=-18 kJ·mol-1
(aq)===BaSO4(s) ΔH=-18 kJ·mol-1
C.Ba2+(aq)+SO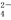 (aq)===BaSO4(s) ΔH=-73 kJ·mol-1[来源
(aq)===BaSO4(s) ΔH=-73 kJ·mol-1[来源
D.Ba2+(aq)+SO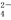 (aq)===BaSO4(s) ΔH=-0.72 kJ·mol-
(aq)===BaSO4(s) ΔH=-0.72 kJ·mol-
查看答案和解析>>
科目:高中化学 来源:2017届山东省东营市高三上期中化学卷(解析版) 题型:选择题
在Na+浓度为0.9 mol·L-1的某澄清溶液中,还可能含有下表中的若干种离子:取该溶液100ml进行如下实验(气体体积在标准状况下测定):
阳离子 | K+、Ag+、Mg2+、Ba2+ |
阴离子 | NO3-、CO32-、SiO32-、SO42- |
I.向该溶液中加入足量稀HCl,产生白色沉淀并放出1.12L气体;II.将I的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称得固体质量为3.6g;III.在II的滤液中滴加BaCl2溶液,无明显现象,下列说法不正确的是( )
A.K+一定存在,且c(K+)≤1.3mol·L-1
B.实验I能确定一定不存在的离子是Ag+、Mg2+、Ba2+
C.实验I中生成沉淀的离子方程式为SiO32-+2H+=H2SiO3↓
D.实验III能确定一定不存在SO42-
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上学期统练三化学试卷(解析版) 题型:填空题
(1)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。向浓度均为0.20mol/L的MgCl2和CaCl2混合溶液中逐滴加人Na3P04,先生成___________沉淀(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol/L)时,溶液中的另一种金属阳离子的物质的量浓度c=____________mol/L。
(2)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
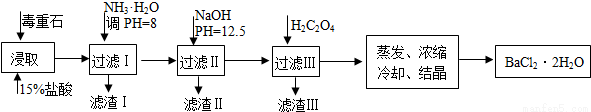
①毒重石用盐酸浸取前需充分研磨,目的是_____________________。
②加入NH3·H2O调节PH=8可除去_____________(填离子符号),滤渣II中含____________(填化学式)。加入H2C2O4时应避免过量,原因是_________________。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(3)已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100mL该条件下的CaSO4饱和溶液中加入400mL0.01mol/LNa2SO4溶液,下列叙述正确的是
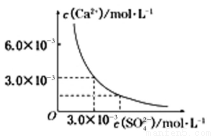
A.溶液中析出CaSO4固体沉淀,最终溶液中c(SO42-)比原来的大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C.溶液中析出CaSO4固体沉淀.溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高一上期中化学卷(解析版) 题型:选择题
取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圆为白色,外圆呈浅红色。则下列说法错误的 是
是

A.a电极生成物是Cl2 B.b电极与电源的负极相连接
C.电解过程中,水是氧化剂 D.b电极附近溶液的呈酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com