
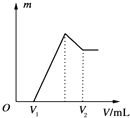
 ½«0.1molµÄĆ¾”¢ĀĮ»ģŗĻĪļČÜÓŚ100mL”¢2mol•L-1µÄH2SO4ČÜŅŗÖŠ£¬Č»ŗóŌŁµĪ¼Ó1mol•L-1µÄNaOHČÜŅŗ£®Ēė»Ų“š£ŗ
½«0.1molµÄĆ¾”¢ĀĮ»ģŗĻĪļČÜÓŚ100mL”¢2mol•L-1µÄH2SO4ČÜŅŗÖŠ£¬Č»ŗóŌŁµĪ¼Ó1mol•L-1µÄNaOHČÜŅŗ£®Ēė»Ų“š£ŗ·ÖĪö £Ø1£©øł¾ŻĶ¼ĻóæÉÖŖ£¬ŌŚµĪ¼ÓNaOHČÜŅŗµ½Ģå»żV1=160mL¹ż³ĢÖŠ£¬Ć»ÓŠ³ĮµķÉś³É£¬ĖµĆ÷ĮņĖįÓŠŹ£Óą£¬µĪ¼ÓµÄNaOHÓĆÓŚÖŠŗĶŹ£ÓąĮņĖį£¬V1=160mLŹ±£¬Ź£ÓąµÄH2SO4ÓėµĪ¼ÓµÄNaOHĒ”ŗĆĶźČ«·“Ó¦£¬ČÜŅŗŹĒMgSO4”¢Al2£ØSO4£©3ŗĶNa2SO4»ģŗĻŅŗ£¬ĮīMgSO4ĪŖxmol£¬Al2£ØSO4£©3ĪŖymol£¬øł¾ŻŹŲŗćĮŠ·½³ĢĒóĖćn£ØMg£©£»
µ±µĪ¼ÓNaOHČÜŅŗµ½Ģå»żV2Ź±£¬Al£ØOH£©3ĶźČ«Čܽā£¬³ĮµķŹĒMg£ØOH£©2£¬ČÜŅŗŹĒNa2SO4ŗĶNaAlO2»ģŗĻŅŗ£®øł¾ŻŹŲŗćÓŠ£ŗn£ØNaOH£©=2n£ØNa2SO4£©+n£ØNaAlO2£©=2n£ØH2SO4£©+n£ØAl£©£¬¾Ż“ĖĒó³ön£ØNaOH£©£¬ŌŁĄūÓĆV=$\frac{n}{c}$¼ĘĖć£»
£Ø2£©µ±ČÜŅŗÖŠMg2+”¢Al3+Ē”ŗĆ³ĮµķĶźČ«Ź±£¬¼“³Įµķ“ļµ½×ī“óÖµ£¬“ĖŹ±£¬ČÜŅŗŹĒNa2SO4ČÜŅŗ£¬øł¾ŻSO42-Ąė×ÓŗĶNa+Ąė×ÓŹŲŗćÓŠn£ØNa+£©=2n£ØNa2SO4£©=2£ØH2SO4£©Ēó³ön£ØNaOH£©£¬ŌŁĄūÓĆV=$\frac{n}{c}$¼ĘĖć£»
£Ø3£©·“Ó¦ŗóµÄ»ģŗĻČÜŅŗ£¬ŌŁ¼ÓČė450mL 1mol/LµÄNaOHČÜŅŗ£¬ĖłµĆ³ĮµķÖŠĪŽAl£ØOH£©3£¬ČÜÖŹĪŖĮņĖįÄĘ”¢Ę«ĀĮĖįÄĘ£¬ÓÉÓŚĪŖ½šŹō»ģŗĻĪļ£¬Ōņa£¼1£¬øł¾ŻÄĘĄė×ÓŹŲŗć£¬Ó¦Āś×ćn£ØNaOH£©”Ż2n£ØNa2SO4£©+n£ØNaAlO2£©£¬øł¾ŻĀĮŌŖĖŲŹŲŗćÓĆx±ķŹ¾³ön£ØNaAlO2£©£¬¾Ż“ĖČ·¶ØaµÄȔֵ·¶Ī§£®£®
½ā“š ½ā£ŗ£Ø1£©100mL 2mol•L-1µÄH2SO4ČÜŅŗÖŠĮņĖįµÄĪļÖŹµÄĮæĪŖ0.1L”Į2mol/L=0.2mol£¬
µ±V1=160mLŹ±£¬“ĖŹ±£¬ČÜŅŗŹĒMgSO4”¢Al2£ØSO4£©3ŗĶNa2SO4»ģŗĻŅŗ£¬
ÓÉNa+Ąė×ÓŹŲŗćæÉÖŖ£¬n£ØNa2SO4£©=$\frac{1}{2}$n£ØNa+£©=$\frac{1}{2}$n£ØNaOH£©=$\frac{1}{2}$”Į0.16L”Į1mol/L=0.08mol
ĮīMgSO4ĪŖxmol£¬Al2£ØSO4£©3ĪŖymol£¬Ōņ£ŗ
øł¾ŻMgŌ×Ó”¢AlŌ×ÓŹŲŗćÓŠ£ŗx+2y=0.1
øł¾ŻSO42-Ąė×ÓŹŲŗćÓŠ£ŗx+3y=0.2-0.08
ĮŖĮ¢·½³Ģ£¬½āµĆ£ŗx=0.06£»y=0.02
ĖłŅŌ½šŹō·ŪÄ©ÖŠn£ØMg£©=0.06mol£¬n£ØAl£©=2y=2”Į0.02mol=0.04mol
µĪ¼ÓNaOHČÜŅŗµ½Ģå»żV2Ź±£¬ČÜŅŗŹĒNa2SO4ŗĶNaAlO2»ģŗĻŅŗ£¬øł¾ŻSO42-Ąė×Ó”¢Na+Ąė×ÓŗĶAlŌ×ÓŹŲŗćÓŠ£ŗ
n£ØNaOH£©=2n£ØNa2SO4£©+n£ØNaAlO2£©=2n£ØH2SO4£©+n£ØAl£©=2”Į0.2mol”Į+0.04mol=0.44mol£¬ĖłŅŌ£¬V2=$\frac{0.44mol}{1mol/L}$=0.44L=440mL£¬
¹Ź“š°øĪŖ£ŗ0.06£»440£»
£Ø2£©µ±ČÜŅŗÖŠMg2+”¢Al3+Ē”ŗĆ³ĮµķĶźČ«Ź±£¬“ĖŹ±ČÜŅŗŹĒNa2SO4ČÜŅŗ£¬øł¾ŻSO42-Ąė×ÓŗĶNa+Ąė×ÓŹŲŗćÓŠ£ŗn£ØNa+£©=2n£ØNa2SO4£©=2£ØH2SO4£©=2”Į0.1L”Į2mol/L=0.4mol£¬ĖłŅŌV£ØNaOH£©=$\frac{0.4mol}{1mol/L}$=0.4L=400ml£¬
¹Ź“š°øĪŖ£ŗ400£»
£Ø3£©ÓÉÓŚĪŖ½šŹō»ģŗĻĪļ£¬Ōņa£¼1£¬AlµÄĪļÖŹµÄĮæĪŖ0.1£Ø1-a£©mol£¬·“Ó¦ŗóµÄ»ģŗĻČÜŅŗ£¬ŌŁ¼ÓČė450mL 1mol/LµÄNaOHČÜŅŗ£¬ĖłµĆ³ĮµķÖŠĪŽAl£ØOH£©3£¬ČÜÖŹĪŖĮņĖįÄĘ”¢Ę«ĀĮĖįÄĘ£¬øł¾ŻĀĮŌŖĖŲŹŲŗćæÉÖŖn£ØNaAlO2£©=0.1£Ø1-a£©mol£¬øł¾ŻÄĘĄė×ÓŹŲŗć£¬Ó¦Āś×ćn£ØNaOH£©”Ż2n£ØNa2SO4£©+n£ØNaAlO2£©£¬¼“0.45”Į1”Ż2”Į0.1”Į2+0.1£Ø1-a£©£¬½āµĆa”Ż0.5£¬¹Ź0.5”Üa£¼1£¬
¹Ź“š°øĪŖ£ŗ0.5”Üa£¼1£®
µćĘĄ ±¾ĢāŅŌĶ¼ĻóŠĪŹ½æ¼²é»ģŗĻĪļ¼ĘĖć£¬ÄŃ¶Č½Ļ“ó£¬Ē峞ĆæŅ»¶ĪĶ¼Ļó·¢ÉśµÄ»Æѧ·“Ó¦”¢ÖŖµĄ¹Õµć“ś±ķµÄŗ¬Ņå¼°ČÜŅŗÖŠČÜÖŹµÄ³É·Ö£¬½įŗĻ·½³ĢŹ½¶ŌÓŠ¹ŲĪŹĢā½ųŠŠ·ÖĪö£¬×¢ŅāŹŲŗćĖ¼ĻėµÄŌĖÓĆŹ¹¼ĘĖć¼ņ»Æ£®


 ČżµćŅ»²āæģĄÖÖÜ¼Ę»®ĻµĮŠ“š°ø
ČżµćŅ»²āæģĄÖÖÜ¼Ę»®ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | H2SĘųĢåÄÜÓĆÅØĮņĖį½ųŠŠøÉŌļ£ØÅØĮņĖįµÄĪüĖ®ŠŌ£© | |
| B£® | ĶÓėÅØĻõĖįÖʱøNO2ĘųĢå£ØÅØĻõĖįµÄĒæŃõ»ÆŠŌ”¢ĖįŠŌ£© | |
| C£® | SO2µÄĖ®ČÜŅŗÄܹ»Ź¹Ę·ŗģČÜŅŗĶŹÉ«£ØH2SO3µÄĒæŃõ»ÆŠŌ£© | |
| D£® | æÉæŚæÉĄÖĘæøĒ“ņæŖŗó£¬ÓŠ“óĮæĘųĢåŅŻ³ö£ØH2CO3µÄ»Ó·¢ŠŌ£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | KCl | B£® | PCl3 | C£® | NH3•H2O | D£® | Na2O2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
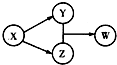 X”¢Y”¢Z”¢WĖÄÖÖĪļÖŹµÄ×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾£Ø²æ·Ö·“Ó¦ĪļÓė²śĪļŅŃĀŌ£©£¬ĻĀĮŠ×éŗĻÖŠ²»·ūŗĻøĆ¹ŲĻµµÄŹĒ£Ø””””£©
X”¢Y”¢Z”¢WĖÄÖÖĪļÖŹµÄ×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾£Ø²æ·Ö·“Ó¦ĪļÓė²śĪļŅŃĀŌ£©£¬ĻĀĮŠ×éŗĻÖŠ²»·ūŗĻøĆ¹ŲĻµµÄŹĒ£Ø””””£©| A | B | C | D | |
| X | HCl | Na2O2 | Na2CO3 | Al |
| Y | FeCl2 | NaOH | CO2 | Na[Al£ØOH£©4] |
| Z | Cl2 | Na2CO3 | CaCO3 | AlCl3 |
| W | FeCl3 | NaHCO3 | Ca£ØHCO3£©2 | Al£ØOH£©3 |
| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
 Ę䏿Äæ·Ö±šÓĆa”¢b”¢c”¢d±ķŹ¾£¬¶ŌĶéĢž£Ø³ż¼×ĶéĶā£©ÖŠ“ęŌŚµÄ¹ŲĻµ×÷ĢÖĀŪ£ŗ
Ę䏿Äæ·Ö±šÓĆa”¢b”¢c”¢d±ķŹ¾£¬¶ŌĶéĢž£Ø³ż¼×ĶéĶā£©ÖŠ“ęŌŚµÄ¹ŲĻµ×÷ĢÖĀŪ£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
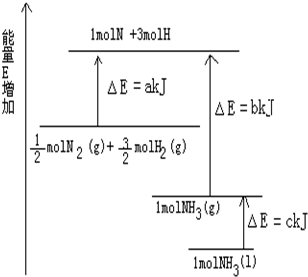 ŅŃÖŖ»Æѧ·“Ó¦N2+3H2ØT2NH3µÄÄÜĮæ±ä»ÆČēĶ¼ĖłŹ¾£¬
ŅŃÖŖ»Æѧ·“Ó¦N2+3H2ØT2NH3µÄÄÜĮæ±ä»ÆČēĶ¼ĖłŹ¾£¬²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | A£Øg£©µÄÄÜĮæŅ»¶ØøßÓŚC£Øg£©µÄÄÜĮæ | |
| B£® | øĆ·“Ó¦²»ŠčŅŖ¼ÓČČ | |
| C£® | 1 mol A£Øg£©ŗĶ2 mol B£Øg£©µÄ×ÜÄÜĮæøßÓŚ1 mol C£Øg£©µÄÄÜĮæ | |
| D£® | øĆ·“Ó¦±ķŹ¾£ŗ1 mol A£Øg£©ŗĶ2 mol B£Øg£©ŌŚŅ»¶ØĢõ¼žĻĀ·“Ó¦·Å³öµÄČČĮæĪŖa kJ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com