
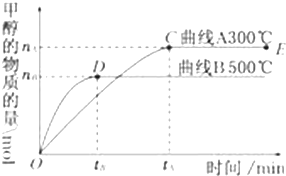
 (1)一定条件下,在体积为4L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g).
(1)一定条件下,在体积为4L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g).| 0.4xmol |
| 4L |
| 4y |
| 4 |
| 消耗量 |
| 起始量 |
| 0.5 |
| 1 |
| c(CH3OH) |
| c(CO)c2(H2) |
| c(CH3OH) |
| c(CO)c2(H2) |
| 0.4xmol |
| 4L |
| 4y |
| 4 |
| 消耗量 |
| 起始量 |
| 0.5 |
| 1 |


科目:高中化学 来源: 题型:
| A、②③ | B、② | C、③④ | D、①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、漂白粉溶液中通入过量的CO2:ClO-+CO2+H2O=HClO+HCO3- | ||||
| B、用碳酸钠溶液吸收Br2:CO32-+Br2+2H2O=Br-+BrO3-+CO2↑+4H+ | ||||
C、用铜电极电解硫酸铜溶液:2Cu2++2H2O
| ||||
| D、已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液中,形成无色溶液,当在Pb(Ac)2醋酸铅溶液中通入H2S时,有黑色沉淀PbS生成:Pb2++2Ac-+H2S=PbS+2HAc |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀释后溶液的pH=7 | ||||
| B、氨水的电离度增大,溶液中所有离子的浓度均减小 | ||||
C、稀释过程中
| ||||
| D、pH=11氨水的浓度为0.001mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 物质 | 试剂 | 方法 |
| A | SiO2(Al2O3) | 氢氧化钠溶液 | 过滤 |
| B | AlCl3(MgCl2) | 氢氧化钠溶液 | 过滤 |
| C | CO2(SO2) | 饱和碳酸氢钠溶液 | 洗气 |
| D | 乙醇(水) | 汽油 | 萃取、分液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,5.6 LNO和16.8 LO2的混合气体中含有分子数为NA |
| B、0.1 mol Fe在氧气中充分燃烧失电子数为0.3NA |
| C、在1 L lmol?L-1的氨水中,含有的NH3与NH3?H2O分子的总数为NA |
| D、标准状况下,40gSO3所占的体积一定小于11.2 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、赤铁矿的主要成分是Fe3O4 |
| B、铁矿石的主要成分与铁锈的主要成分相同 |
| C、磁铁矿粉末溶于盐酸后,加入KSCN溶液,溶液变血红色 |
| D、FeO俗称铁红 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com