
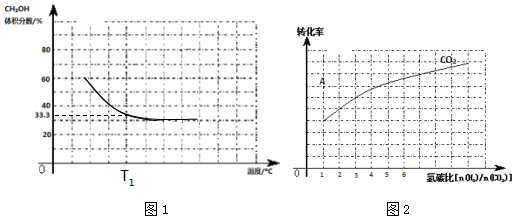
分析 Ⅰ.(1)一定条件下,向容积为2L恒容密闭容器中充入1.2mol CO2(g)和2.8mol H2(g),在不同温度下达平衡时,保持T1恒温下,从开始到平衡所需时间为10分钟.CH3OH的体积分数为33.3%即为$\frac{1}{3}$,设反应的二氧化碳物质的量浓度为x,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始量(mol/L) 0.6 1.4 0 0
变化量(mol/L) x 3x x x
平衡量(mol/L) 0.6-x 1.4-3x x x
$\frac{x}{2-2x}$=$\frac{1}{3}$
x=0.4mol/L
①开始到平衡的平均反应速率v(CO2)=$\frac{△c}{△t}$;
②该温度下反应的平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
(2)保持T1恒温下,从开始到平衡所需时间为10分钟.测定平衡时容器内压强为P1MPa,使上述反应在T2(T1<T2)的恒温下进行并达平衡.测定到平衡所需是为t2分钟,平衡时容器内压强为P2 MPa,温度升高反应速率增大,达到平衡所需时间缩短,反应为放热反应,升温平衡逆向进行气体物质的量增大气体压强增大;
Ⅱ.(3)CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.4kJ/mol,反应物质以不同的氢碳比$\frac{n({H}_{2})}{n(C{O}_{2})}$反应,当比值越二氧化碳的转化率越大,氢气转化率减小,比值为3时和反应比相同,二者转化率相同,据此画出氢气转化率变化曲线;
Ⅲ.已知①2CH3OH(g)=CH3OCH3(g)+H2O(g)△H=-25.kJ/mol,
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.4kJ/mol
盖斯定律计算得到:②×2+①得到所需热化学方程式.
解答 解:Ⅰ.(1)一定条件下,向容积为2L恒容密闭容器中充入1.2mol CO2(g)和2.8mol H2(g),在不同温度下达平衡时,保持T1恒温下,从开始到平衡所需时间为10分钟.CH3OH的体积分数为33.3%即为$\frac{1}{3}$,设反应的二氧化碳物质的量浓度为x,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始量(mol/L) 0.6 1.4 0 0
变化量(mol/L) x 3x x x
平衡量(mol/L) 0.6-x 1.4-3x x x
$\frac{x}{2-2x}$=$\frac{1}{3}$
x=0.4mol/L
①开始到平衡的平均反应速率v(CO2)=$\frac{0.4mol/L}{10min}$=0.04mol/(L•min),故答案为:0.04;
②该温度下反应的平衡常数K=$\frac{0.4×0.4}{0.2×0.{2}^{3}}$=100(mol/L)-2,故答案为:100(mol/L)-2;
(2)保持T1恒温下,从开始到平衡所需时间为10分钟.测定平衡时容器内压强为P1MPa,使上述反应在T2(T1<T2)的恒温下进行并达平衡.测定到平衡所需是为t2分钟,平衡时容器内压强为P2 MPa,温度升高反应速率增大,达到平衡所需时间缩短,t2<10,反应为放热反应,升温平衡逆向进行气体物质的量增大气体压强增大,
P2>P1,
故答案为:<;>;
(3)CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.4kJ/mol,反应物质以不同的氢碳比$\frac{n({H}_{2})}{n(C{O}_{2})}$反应,当比值越二氧化碳的转化率越大,氢气转化率减小,比值为3时和反应比相同,二者转化率相同,据此画出氢气转化率变化曲线为: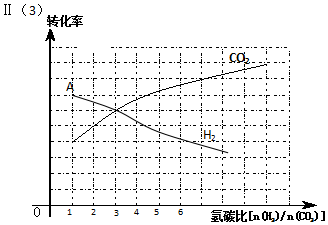
故答案为: ;
;
Ⅲ.已知①2CH3OH(g)=CH3OCH3(g)+H2O(g)△H=-25.kJ/mol,
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.4kJ/mol
盖斯定律计算得到:②×2+①得到:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g)△H=-123.8 kJ/mol
故答案为:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g)△H=-123.8 kJ/mol.
点评 本题考查了化学反应速率、平衡影响因素、平衡常数计算、图象的理解应用、热化学方程式书写等知识点,掌握基础是解题关键,题目难度中等.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠与过量的氢氧化钙溶液反应:HCO3-+OH-+Ca2+═CaCO3↓+H2O | |
| B. | 过氧化钠与水的反应:2 O22-+2H2O═4 OH-+O2↑ | |
| C. | 碳酸钙加入醋酸CO32-+2CH3COOH═CO2↑+2CH3COO-+H2O | |
| D. | 铁与稀盐酸的反应:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度可增大单位体积活化分子数百分数,促进有效碰撞,从而提高反应速率 | |
| B. | 增大体系压强可增大单位体积活化分子数,促进有效碰撞,从而提高反应速率 | |
| C. | 放热反应(△H<0)和熵增(△S>0)反应一定能自发反应 | |
| D. | 由能量守恒可知任何放热反应都可设计成原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
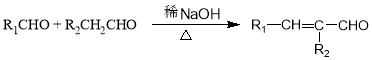
 (R为烃基),其中一种辣椒素酯类化合物J的合成路线如图:
(R为烃基),其中一种辣椒素酯类化合物J的合成路线如图: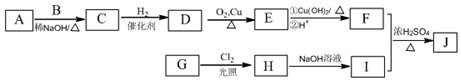
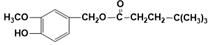 .
.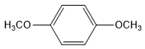 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L乙烯含有的共用电子对数为5NA | |
| B. | 8.0gCu2S和CuO的混合物中含有的铜原子数为0.1NA | |
| C. | 电解饱和食盐水时,阳极生成22.4L气体时,转移的电子数为2NA | |
| D. | 室温下向1L pH=1的醋酸溶液中加水,所得溶液中H+数目小于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | |||
| X | Y | Z |
| A. | 原子半径大小:X>Y>Z | |
| B. | W、Y两种元素都能与氧元素形成化合物WO2、YO2 | |
| C. | 最高价氧化物对应水化物的酸性:W>Y>Z | |
| D. | W元素的单质能从X的氧化物中置换出X单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com