
【题目】I.物质的类别和核心元素的化合价是研究物质性质的两个基本视角。请根据下图所示,回答下列问题:

(1)X的化学式为____________。
(2)W的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为______________________。
(3)已知SO3是一种酸性氧化物,则SO3与NaOH溶液反应的离子方程式为__________________________________。
(4)欲制备Na2S2O3(硫代硫酸钠),从氧化还原反应角度分析,合理的是_______(填序号)。
A.Na2S+S B.Na2SO3+S C.Na2SO3+Na2SO4 D.SO2+Na2SO4
(5)将X与Y混合,可生成淡黄色固体,该反应的氧化产物与还原产物的质量之比为_____。
Ⅱ.如图所示:图中每一方格表示有关的一种反应物或生成物,其中A、C为无色气体,请填写下列空白:
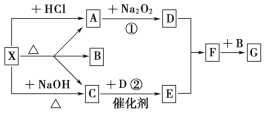
(1)物质X可以是_____________,C是______,F是_______。
(2)反应①的化学方程式是________________________________________。反应②的化学方程式是___________________________________________。
【答案】H2S Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O SO3+2OH=SO42+H2O B 2∶1 (NH4)2CO3或NH4HCO3 NH3 NO2 2Na2O2+2CO2===2Na2CO3+O2 4NH3+5O2
CuSO4+SO2↑+2H2O SO3+2OH=SO42+H2O B 2∶1 (NH4)2CO3或NH4HCO3 NH3 NO2 2Na2O2+2CO2===2Na2CO3+O2 4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
【解析】
I.依据元素化合价和物质分类分析,X为气态氢化物为H2S,Y为硫元素的+4价氧化物为SO2,Z为+4价的盐可以为Na2SO3,W为+6价的含氧酸为H2SO4;
Ⅱ.X既能与盐酸反应,又能与NaOH反应,都生成气体,且加热能分解,应为弱酸铵盐,则C为NH3,气体A能与过氧化钠反应,故A为CO2,则A应为(NH4)2CO3或NH4HCO3,B为H2O,结合转化关系可知,D为O2,E为NO,F为NO2,G为HNO3,
I.(1)X为气态氢化物为H2S;
(2)W的浓溶液是浓硫酸溶液,与铜单质在加热条件下可以发生化学反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑;
CuSO4+2H2O+SO2↑;
(3)SO3与NaOH溶液反应生成硫酸钠和水,反应的离子方程式为SO3+2OH-=SO42-+H2O;
(4)Na2S2O3中S为+2价,从氧化还原的角度分析,反应物中S元素化合价必须分别大于2和小于2,A中S化合价都小于2,C和D中S的化合价都大于2,所以B符合题意;
(5)将X为H2S与SO2混合,可生成淡黄色固体,是用二氧化硫的氧化性氧化硫化氢生成淡黄色沉淀S和水,2H2S+SO2=3S↓+2H2O,反应中硫元素化合价-2价变化为0价,H2S做还原剂,+4价变化为0价,二氧化硫做氧化剂,则氧化产物与还原产物的质量之比为2:1;
Ⅱ. (1)由上述分析可知,物质X可以是(NH4)2CO3或NH4HCO3,C是NH3,F是NO2;
(2)反应①为二氧化碳和过氧化钠的反应,方程式为2Na2O2+2CO2===2Na2CO3+O2;
反应②为氨气的催化氧化反应,方程式为4NH3+5O2 4NO+6H2O。
4NO+6H2O。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下表给出七种元素的相关信息,根据以下信息填空:
元素 | 相关信息 |
A | 核外电子数和电子层数相等 |
B | 基态原子2p能级有3个未成对电子 |
C | 在地壳中含量最高 |
D | 目前,在元素周期表中电负性最大 |
E | 基态原子核外电子分处6个不同能级,且每个能级均已排满 |
F | 原子序数等于D与E的原子序数之和 |
G | 基态原子2p能级上有两个空轨道 |
(1)写出D在元素周期表中的位置___________________。
(2)14gB的单质分子中π键的个数为____________。
(3)C元素的氢化物的沸点是同族元素氢化物中最高的,原因是________。
(4)B、C、D 3种元素的电负性由大到小的顺序为________(用元素符号表示)。
(5)写出一种与B2互为等电子体的分子或离子____________。
(6)已知BA5为离子化合物,写出其电子式:_______。
(7)第二周期中,第一电离能介于B元素和G 元素间的元素为 ____(填“元素符号”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z组成的化合物Y2X和ZX2。Y2X溶于水形成的溶液能与ZX2反应生成一种化合物Y2ZX3。已知三种元素原子的质子总数为25,且Z和Y的原子序数之和比X的原子序数2倍还多1,Z原子有2个电子层,最外层电子数是核外电子数的2/3倍,试回答:
(1)X元素的名称:X____,Y元素在元素周期表中的位置____,Z元素的原子结构示意图_______。
(2)用电子式表示ZX2的形成过程_____。
(3)Y2X对应水化物的电子式_____,其中存在的化学键有_____。
(4)写出Y2X溶于水的溶液与ZX2反应的化学方程式_______。
(5)X的氢化物比同主族的氢化物的熔沸点明显偏高的原因____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下进行甲、乙、丙三组实验:三组各取30.0 mL同浓度的盐酸溶液,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:
实验序号 | 甲 | 乙 | 丙 |
合金质量/mg | 255 | 385 | 459 |
产生气体体积/mL | 280 | 336 | 336 |
请回答:
(1)甲组实验中,盐酸______________(选填“适量”“过量”或“不足量”,下同),理由是______________。要算出盐酸的物质的量浓度,题中可作计算依据的数据是______________。求得的盐酸的物质的量浓度为______________。
(2)求合金中Mg、Al的物质的量之比,题中可作计算依据的数据是______________,求得的Mg、Al的物质的量之比为______________;
(3)在丙组实验之后,向容器中加入1.00 mol·L-1 NaOH溶液,能使合金中的铝恰好溶解,不形成铝的沉淀,并使Mg2+刚好沉淀完全,再过滤出不溶性固体,求滤液中各溶质的物质的量和所加入NaOH溶液的体积(写计算过程)。___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑色固体物质A有如下图所示的转化关系。每个方框表示有一种反应物或生成物(反应条件及生成的水已略去),其中C、F常温下为无色气体,D、E有共同的阳离子。
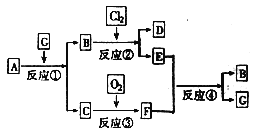
⑴写出B和C的化学式:B______________;C______________。
⑵写出反应④的离子方程式______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-中的几种,为确定其成分,完成了如下实验(已知:3NO3-+8Al+5OH-+2H2O ![]() 3NH3↑+ 8AlO2- )
3NH3↑+ 8AlO2- )
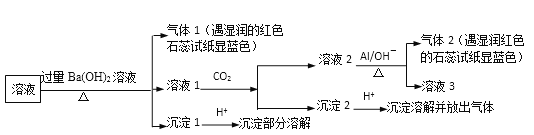
根据实验现象,所得结论错误的是
A.沉淀1加酸部分溶解,则含Mg2+和SO42-B.可能含Na+、Cl-
C.沉淀2加酸溶解,则含Al3+D.气体1遇水显碱性,则含NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是分离混合物时常用的仪器,回答下列问题:
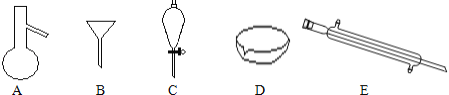
(1)写出仪器C的名称___。
(2)分离以下混合物应该主要选用上述什么仪器?(填字母符号)
①NaCl固体和泥沙:___;②花生油和水:___。
(3)若向C装置中加入碘水和足量CCl4,充分振荡后静置,观察到现象是:C内液体分两层,上层液体___色,下层液体___色。
(4)溴单质和碘单质有相类似的性质,若利用C仪器提取溴水中的溴单质,下列有机溶剂中不能选用的是:___。
A.汽油 B.CCl4 C.酒精 D.醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于A2+3B2≒2C的反应来说,以下化学反应速率的表示中,反应速率最慢的是
A.v(B2)=0.8mol/(Ls);B.v(A2)=0.4mol/(Ls);
C.v(C)=0.6mol/(Ls);D.v(B2)=4.2mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸镁和硫酸铝的混合溶液中,c(Mg2+ )=2 mol·L-1,c(SO42-)=6.5 mol·L-1,若将200 mL此混合液中的Mg2+和Al3+分离,至少应加入1.6 mol·L-1氢氧化钠溶液的体积是
A.0.5 L B.1.625 LC.1.8 LD.2 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com