
| 步骤Ⅰ | 称取样品Wg配成溶液置于锥形瓶中,并调节PH≤2.0 |
| 步骤Ⅱ | 向锥形瓶中加入足量KI晶体,充分搅拌,并加入少量指示剂 |
| 步骤Ⅲ | 用c mol/L的Na2S2O3溶液滴定 |
分析 (1)①盐酸和NaClO3反应时有ClO2和Cl2生成,反应中HCl为还原剂,被氧化生成氯气,化合价由-1价升高到0价,NaClO3被还原成ClO2,氯从+5价变为+4价,据此书写离子方程式和计算还原剂的物质的量;
②双氧水作还原剂时氧化产物为氧气,对环境无污染;
(2)①步骤Ⅱ中发生反应是酸性溶液中ClO2-能被I-完全还原成Cl-,碘离子被氧化为碘单质,溶液中Na2S2O3能与I2反应:2Na2S2O3+I2=2NaI+Na2S4O6,可以用淀粉溶液作指示剂,判断反应终点;
②依据ClO2-+4H++4I-=2I2+Cl-+2H2O,2Na2S2O3+I2=2NaI+Na2S4O6,反应的定量关系计算得到;
(3)每摩尔Cl2得到2mol电子,而每摩尔ClO2得到5mol电子,故为2.5倍.
解答 解:(1)①盐酸和NaClO3反应时有ClO2和Cl2生成,反应的离子方程式为 2ClO3-+4H++2Cl-=2ClO2↑+Cl2↑+2H2O,反应中HCl为还原剂,被氧化生成氯气,化合价由-1价升高到0价,当转移0.2mol电子时,参加反应的还原剂的物质的量为为0.2mol,
故答案为:2ClO3-+4H++2Cl-=2ClO2↑+Cl2↑+2H2O;0.2mol.
②双氧水作还原剂时氧化产物为氧气,对环境无污染,
故答案为:使用双氧水作还原剂时氧化产物为氧气,对环境无污染;
(2)①步骤Ⅱ中发生反应是酸性溶液中ClO2-能被I-完全还原成Cl-,碘离子被氧化为碘单质,离子方程式为:ClO2-+4H++4I-=2I2+Cl-+2H2O,溶液中Na2S2O3能与I2反应:2Na2S2O3+I2=2NaI+Na2S4O6,可以用淀粉溶液作指示剂,
故答案为:ClO2-+4H++4I-=2I2+Cl-+2H2O,淀粉溶液;
②依据ClO2-+4H++4I-=2I2+Cl-+2H2O,2Na2S2O3+I2=2NaI+Na2S4O6,反应的定量关系计算得到,设NaClO2,
ClO2-~2I2~4Na2S2O3+
1 4
x cV×10-3mol
x=$\frac{cV×10{\;}^{-3}}{4}$,
样品中NaClO2的质量分数=$\frac{\frac{cV×10{\;}^{-3}}{4}mol×90.5g/mol}{Wg}$×100%=$\frac{9.05×10{\;}^{-2}VC}{4W}$×100%,
故答案为:$\frac{9.05×10{\;}^{-2}VC}{4W}$×100%.
(3)每摩尔Cl2得到2mol电子,而每摩尔ClO2得到5mol电子,则所需Cl2的物质的量是ClO2的:$\frac{5mol}{2mol}$=2.5倍,
故答案为:2.5.
点评 本题考查亚氯酸钠制备实验的基本操作、亚氯酸钠的性质及中和滴定等知识,理解原理是解题的关键,同时考查学生分析问题、解决问题的能力,难度较大.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:解答题
 Ⅰ.体积为5L的恒温、恒容密闭容器甲起始投入2molN2、3molH2经过l0s达平衡,测得平衡时NH3的物质的量为0.8mol.
Ⅰ.体积为5L的恒温、恒容密闭容器甲起始投入2molN2、3molH2经过l0s达平衡,测得平衡时NH3的物质的量为0.8mol.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用O3替代Cl2作饮用水消毒剂更符合绿色化学的要求 | |
| B. | “光化学烟雾”、“臭氧空洞”的形成都与氮氧化合物有关 | |
| C. | 尽量使用含12C的产品,减少使用含13C或14C的产品符合“促进低碳经济”宗旨 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用pH计测定0.1mol/L氨水的pH | |
| B. | 用pH试纸测定0.1mol/LNH4Cl溶液的pH | |
| C. | 将氨水连接在一个带灯泡的通电电路中,观察灯泡亮度 | |
| D. | 等浓度、等体积的氨水和NaOH分别与等浓度的盐酸反应,比较消耗盐酸体积的多少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4的摩尔质量是98 | |
| B. | 通电时,溶液中的溶质分子分别向两极移动,胶体中的分散质粒子向某一极移动 | |
| C. | 丁达尔效应可用于区别溶液和胶体,云、雾均能产生丁达尔效应 | |
| D. | 将98gH2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
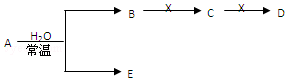
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )
将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )| A | B | C | D | |
| X | CO2 | HCl | NaOH | AlCl3 |
| Y | Ca(OH)2 | Na[Al(OH)4] | AlCl3 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com