
| A. | 油脂分子中都含有碳碳双键 | B. | 葡萄糖分子中含有羟基和醛基 | ||
| C. | 水分子中含有羟基 | D. | 乙酸乙酯分子中含有羧基 |
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1mol的白磷(P4)或CCl4中所含的共价键数均为0.4NA | |
| B. | S2和S8的混合物共6.4g,其中所含的电子数一定为3.2NA | |
| C. | 5.4gAl分别于含溶质0.2mol的NaOH溶液、盐酸反应,生成H2分子数均为0.3NA | |
| D. | 在H2O2+Cl2═2HCl+O2反应中,每生成32gO2,转移4 NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Na2O2与2 mol NaHCO3固体混合物在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是NaOH和Na2CO3 | |
| B. | 由Na2O、Na2O2、Na2CO3.10H2O组成的混合物0.05 mol,溶于水后加入50 mL 1 mol/L的硫酸恰好完全反应,则原混合物中各成分的物质的量之比可为任意值 | |
| C. | 将mg CO和H2的混合气体在足量氧气中完全燃烧,再将燃烧后的气体用足量Na2O2充分吸收,Na2O2增重mg | |
| D. | 将钠与氧气反应的生成物1.5 g溶于水,所得溶液恰好能被80 mL浓度为0.50 mol/L的HCl溶液中和,则该生成物的成分是Na2O和Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚氯乙烯的单体是CH2=CHCl | |
| B. | 通过加聚反应得到的聚乙烯属于天然高分子化合物 | |
| C. | 聚乙烯的链节是CH2=CH2 | |
| D. | 聚乙烯的产量是衡量一个国家石油化工发展水平的标志 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
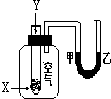 某学生用如图所示装置进行化学反应X+2Y═2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到U型管中液面甲处降乙处升.关于该反应的下列叙述:①该反应为放热反应;②生成物的总能量比反应物更高;③该反应过程可以看成是“贮存”于X、Y内部的能量部分转化为热量而释放出来.其中正确的是( )
某学生用如图所示装置进行化学反应X+2Y═2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到U型管中液面甲处降乙处升.关于该反应的下列叙述:①该反应为放热反应;②生成物的总能量比反应物更高;③该反应过程可以看成是“贮存”于X、Y内部的能量部分转化为热量而释放出来.其中正确的是( )| A. | ①②③ | B. | ①③ | C. | ①② | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
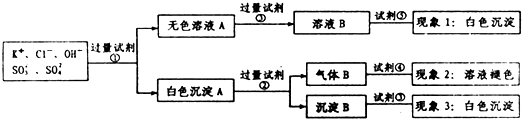
| A. | 试剂③是AgNO3溶液,试剂⑤是HNO3,现象1中白色沉淀是AgCl | |
| B. | 现象3中白色沉淀是BaSO4 | |
| C. | 试剂②是盐酸,试剂③是硝酸 | |
| D. | 产生现象2的离子方程式是:Br2+2H2O+SO2═4H++2Br-+SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
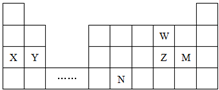
| A. | 原子半径:X>Y>W | |
| B. | 单质的氧化性:W>Z | |
| C. | 溴与元素M同主族,气态氢化物的稳定性比M的强 | |
| D. | 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
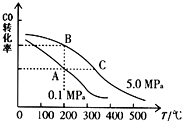 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com