
| Ćū³Ę | ·Ö×ÓŹ½ | Ķā¹Ū | ·Šµć |
| øßĀČĖį | HClO4 | ĪŽÉ«ŅŗĢå | 130”ę |
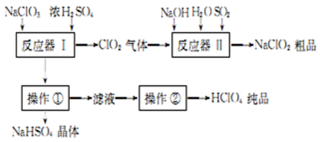
·ÖĪö NaClO3ŗĶÅØH2SO4ŌŚ·“Ó¦Ę÷IÖŠ·“Ó¦£ŗ3NaClO3+3H2SO4=HClO4+2ClO2”ü+3NaHSO4+H2O£»Éś³ÉHClO4”¢ClO2ŗĶNaHSO4£¬ClO2ŌŚ·“Ó¦Ę÷IIÖŠÓė¶žŃõ»ÆĮņ”¢ĒāŃõ»ÆÄĘ·“Ó¦2ClO2+SO2+4NaOHØT2NaClO2+Na2SO4+2H2O£»Éś³ÉŃĒĀČĖįÄĘ£¬ŌŁµĆµ½Ę侧Ģ壻·“Ó¦Ę÷IÖŠµĆµ½µÄČÜŅŗĶعżĄäČ“¹żĀĖµĆµ½NaHSO4¾§Ģ壬ĀĖŅŗĪŖHClO4£¬ÕōĮóµĆµ½“æ¾»µÄHClO4£¬¾Ż“Ė·ÖĪö½ā“š£®
½ā“š ½ā£ŗ£Ø1£©Ķعż²Ł×÷¢ŁµĆµ½ĀĖŅŗ£¬Ōņ²Ł×÷¢ŁĪŖ¹żĀĖ£¬ĀĖŅŗĪŖHClO4£¬Ķعż²Ł×÷¢ŚµĆµ½“æ¾»µÄHClO4£¬ÓÉĢāæÉÖŖ£¬ÓĆÕōĮóæɽ«HClO4“ÓĖ®ÖŠ·ÖĄė³ö£»
¹Ź“š°øĪŖ£ŗ¹żĀĖ£»ÕōĮó£»
£Ø2£©NaClO3ŗĶÅØH2SO4ŌŚ·“Ó¦Ę÷IÖŠ·“Ó¦£ŗ3NaClO3+3H2SO4=HClO4+2ClO2”ü+3NaHSO4+H2O£»
¹Ź“š°øĪŖ£ŗ3NaClO3+3H2SO4=HClO4+2ClO2”ü+3NaHSO4+H2O£»
£Ø3£©·“Ó¦Ę÷¢ņÖŠClO2Óė¶žŃõ»ÆĮņ”¢ĒāŃõ»ÆÄĘ·“Ӧɜ³ÉŃĒĀČĖįÄĘ£¬Ęä·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗ4OH-+SO2+2ClO2=2ClO2-+SO42-+2H2O£»
¹Ź“š°øĪŖ£ŗ4OH-+SO2+2ClO2=2ClO2-+SO42-+2H2O£»
£Ø4£©Čō·“Ó¦Ę÷¢ņÖŠSO2ŅŌH2O2“śĢęŅ²æÉ“ļµ½Ķ¬ŃłµÄÄ棬ŌņClO2ÓėH2O2”¢ĒāŃõ»ÆÄĘ·“Ӧɜ³ÉŃĒĀČĖįÄĘ£¬ŌņH2O2±»Ńõ»ÆĪŖŃõĘų£¬Ąė×Ó·½³ĢŹ½ĪŖ£ŗ2ClO2+2OH-+H2O2=2ClO2-+O2+2H2O£»
¹Ź“š°øĪŖ£ŗ2ClO2+2OH-+H2O2=2ClO2-+O2+2H2O£»
£Ø5£©ÉčŠčŅŖNaClO3x£¬
øł¾Ż·½³ĢŹ½3NaClO3+3H2SO4=HClO4+2ClO2”ü+3NaHSO4+H2O£¬
3”Į106.5g 100.5g
x 201kg
x=639kg£»
¹Ź“š°øĪŖ£ŗ639£»
£Ø6£©µē½āŃĪĖįµÄµē½ā³ŲÖŠ£¬Ńō¼«ŹĒCl-Ź§µē×Ó·¢ÉśŃõ»Æ·“Ó¦µÄ¹ż³Ģ£¬¼“µē¼«·“Ó¦Ź½ĪŖ£ŗHCl+4H2O-8e-=HClO4+8H+£»
¹Ź“š°øĪŖ£ŗHCl+4H2O-8e-=HClO4+8H+£®
µćĘĄ ±¾Ģāæ¼²éĪļÖŹµÄÖʱøŹµŃé¼°»ģŗĻĪļµÄ·ÖĄėŗĶĢį“棬ĪŖøßĘµæ¼µć£¬°ŃĪÕĮ÷³ĢĶ¼ÖŠĆæŅ»²½·¢ÉśµÄ·“Ó¦¼°²Ł×÷·½·ØŹĒ½ā±¾Ģā¹Ų¼ü£¬×¢Ņā½įŗĻĢāøųŠÅĻ¢½ā“š£¬²ąÖŲ·ÖĪöÓėŹµŃéÄÜĮ¦µÄ漲飬ĢāÄæÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŅŃÖŖ£ŗH2£Øg£©+F2£Øg£©ØT2HF£Øg£©”÷H=-546.6 kJ•mol-1£¬Ōņ1 molĒāĘųÓė1 mol·śĘų·“Ӧɜ³É2mol ŅŗĢ¬·ś»ÆĒā·Å³öµÄČČĮæŠ”ÓŚ546.6 kJ | |
| B£® | 500”ę”¢30 MPaĻĀ£¬½«0.5 mol N2£Øg£©ŗĶ1.5 mol H2£Øg£© ÖĆÓŚĆܱÕČŻĘ÷ÖŠ³ä·Ö·“Ӧɜ³ÉNH3£Øg£©·ÅČČ19.3 kJ£®ĘäČČ»Æѧ·½³ĢŹ½ĪŖ£ŗN2£Øg£©+3H2£Øg£©?2NH3£Øg£©”÷H=-38.6 kJ•mol-1 | |
| C£® | H+£Øaq£©+OH-£Øaq£©ØTH2O£Øl£©”÷H=-57.3 kJ•mol-1£¬ŌņH2SO4£Øaq£©+Ca£ØOH£©2£Øaq£©ØTCaSO4£Øs£©+2H2O£Øl£©”÷H=2”Į£Ø-57.3£©kJ•mol-1 | |
| D£® | ŌŚ101 kPaŹ±£¬2 g H2ĶźČ«Č¼ÉÕÉś³ÉŅŗĢ¬Ė®£¬·Å³ö285.8 kJČČĮ棬ĒāĘųČ¼ÉÕµÄČČ»Æѧ·½³ĢŹ½±ķŹ¾ĪŖ2H2£Øg£©+O2£Øg£©ØT2H2O£Øl£©”÷H=-571.6 kJ•mol-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 5ÖÖ | B£® | 8ÖÖ | C£® | 6ÖÖ | D£® | 7ÖÖ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | SiH4±ČCH4ĪČ¶Ø | |
| B£® | PŗĶAsŹōÓŚµŚ¢õA×åŌŖĖŲ£¬H3PO4ĖįŠŌ±ČH3AsO4µÄČõ | |
| C£® | NaŗĶCsŹōÓŚµŚ¢ńA×åŌŖĖŲ£¬CsŹ§µē×ÓÄÜĮ¦±ČNaµÄĒæ | |
| D£® | O2-°ė¾¶±ČF-µÄŠ” |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĶʶĻĢā
 £»
£» £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | ¢ņAŗĶ¢÷A | B£® | ¢õAŗĶ¢öA | C£® | ¢öAŗĶ¢öA | D£® | ¢ńAŗĶ¢öA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | ĶķÉĻ·¢ÉśµÄŹĒ·ÅČČ·“Ó¦ | B£® | °×Ģģ½«»ÆѧÄÜ×Ŗ»ÆĪŖĢ«ŃōÄÜ | ||
| C£® | ĶķÉĻ½«»ÆѧÄÜ×Ŗ»ÆĪŖČČÄÜ | D£® | “Ė·ØæɼõÉŁĪĀŹŅĘųĢåµÄÅÅ·Å |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¼×ĶéµÄČ¼ÉÕČČĪŖ890.3 kJ•mol-1£¬Ōņ¼×ĶéČ¼ÉÕµÄČČ»Æѧ·½³ĢŹ½æɱķŹ¾ĪŖCH4£Øg£©+2O2£Øg£©=CO2£Øg£©+2H2O£Øg£©”÷H=-890.3 kJ•mol-1 | |
| B£® | 500”ę”¢30 MPaĻĀ£¬½«0.5 mol N2£Øg£©ŗĶ1.5 mol H2£Øg£©ÖĆÓŚĆܱÕČŻĘ÷ÖŠ³ä·Ö·“Ӧɜ³ÉNH3£Øg£©·ÅČČ19.3 kJ£¬ĘäČČ»Æѧ·½³ĢŹ½ĪŖN2£Øg£©+3H2£Øg£©?2NH3£Øg£©”÷H=-38.6 kJ•mol-1 | |
| C£® | HClŗĶNaOH·“Ó¦µÄÖŠŗĶČČ”÷H=-57.3 kJ•mol£¬ŌņH2SO4ŗĶCa£ØOH£©2·“Ó¦µÄÖŠŗĶČČ”÷H=2”Į£Ø-57.3£©kJ•mol-1 | |
| D£® | ŌŚ101 kPaŹ±£¬2 g H2ĶźČ«Č¼ÉÕÉś³ÉŅŗĢ¬Ė®£¬·Å³ö285.8 kJČČĮ棬ĒāĘųČ¼ÉÕµÄČČ»Æѧ·½³ĢŹ½±ķŹ¾ĪŖ2H2£Øg£©+O2£Øg£©=2H2O£Øl£©”÷H=-571.6 kJ•mol-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÓĶÖ¬æÉÓĆÓŚÖĘŌģ·ŹŌķ | |
| B£® | Š”ĖÕ“ņæÉÓĆÓŚÖĪĮĘĪøĖį¹ż¶ą | |
| C£® | ĒāŃõ»ÆĢś½ŗĢåÓĆÓŚĻū¶¾¾»Ė® | |
| D£® | ČȵÄĢ¼ĖįÄĘČÜŅŗæÉČ„³żĶʬ±ķĆęµÄÓĶĪŪ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com