
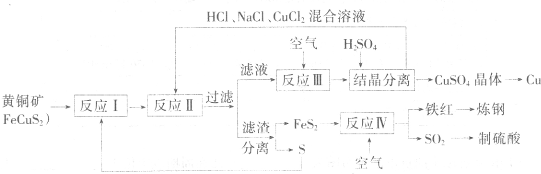
一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高。其主要流程如下:

注:反应Ⅱ的离子方程式为Cu2++CuS+4Cl—=2CuCl2-+S
请回答下列问题:
⑴反应Ⅰ的产物为(填化学式) ▲ 。
⑵反应Ⅲ的离子方程式为 ▲ 。
⑶一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其原因是
▲ 。
⑷炼钢时,可将铁红投入熔融的生铁中,该过程中主要反应的化学方程式是 ▲ 。
⑸某硫酸厂为测定反应Ⅳ所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。
已知:Cr2O72-+ Fe2++ H+→Cr3++ Fe3++ H2O(未配平)
①SO2通入Fe2(SO4)3溶液,发生反应的离子方程式为 ▲ 。
②反应Ⅳ所得气体中SO2的体积分数为 ▲ 。
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:阅读理解
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | 2- 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
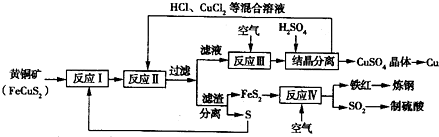
一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高。其主要流程如下:
注:反应Ⅱ的离子方程式为Cu2++CuS+4Cl—=2CuCl2-+S
请回答下列问题:
⑴反应Ⅰ的产物为(填化学式) ▲ 。
⑵反应Ⅲ的离子方程式为 ▲ 。
⑶一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其原因是
▲ 。
⑷炼钢时,可将铁红投入熔融的生铁中,该过程中主要反应的化学方程式是 ▲ 。
⑸某硫酸厂为测定反应Ⅳ所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00mL 。
已知:Cr2O72-+ Fe2++ H+→Cr3++ Fe3++H2O(未配平)
①SO2通入Fe2(SO4)3溶液,发生反应的离子方程式为 ▲ 。
②反应Ⅳ所得气体中SO2的体积分数为 ▲ 。
查看答案和解析>>
科目:高中化学 来源:2011届江苏省扬州中学高三下学期开学练习化学试卷 题型:填空题
一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高。其主要流程如下:
注:反应Ⅱ的离子方程式为Cu2++CuS+4Cl—=2CuCl2-+S
请回答下列问题:
⑴反应Ⅰ的产物为(填化学式) ▲ 。
⑵反应Ⅲ的离子方程式为 ▲ 。
⑶一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其原因是
▲ 。
⑷炼钢时,可将铁红投入熔融的生铁中,该过程中主要反应的化学方程式是 ▲ 。
⑸某硫酸厂为测定反应Ⅳ所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。
已知:Cr2O72-+ Fe2++ H+→Cr 3++
3++  Fe3++ H2O(未配平)
Fe3++ H2O(未配平)
①SO2通入Fe2(SO4)3溶液,发生反应的离子方程式为 ▲ 。
②反应Ⅳ所得气体中SO2的体积分数为 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com