
下列反应需要加入氧化剂才能实现的是…( )
A.Cl2→Cl- B.H+→H2 C.![]() →Mn2+ D.Zn→Zn2+
→Mn2+ D.Zn→Zn2+
 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:阅读理解
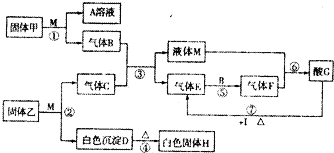
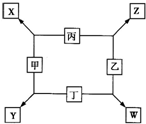 甲、乙、丙、丁均是由短周期元素组成的单质,X、Y、Z、W均为化合物,常温下,X为淡黄色固体,Z遇空气变为红棕色,W能使湿润的红色石蕊试纸变蓝色,工业上常用W来制取Z,其转化关系如右图所示.
甲、乙、丙、丁均是由短周期元素组成的单质,X、Y、Z、W均为化合物,常温下,X为淡黄色固体,Z遇空气变为红棕色,W能使湿润的红色石蕊试纸变蓝色,工业上常用W来制取Z,其转化关系如右图所示.
| ||
| ||
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| Cu |
| △ |
| Cu |
| △ |
| Cu |
| △ |
| Cu |
| △ |
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
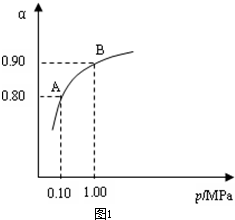 工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列个问题:
工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列个问题:| 催化剂 | △ |
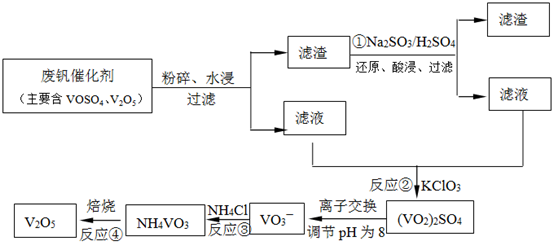
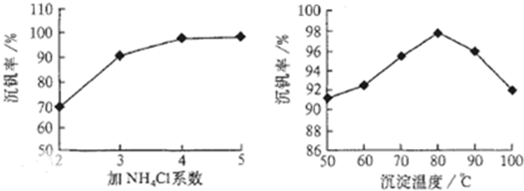
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com