
【题目】W、X、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Z是非金属元素,W、X的最高价氧化物对应的水化物可以相互反应生成盐和水。向一定量的W的最高价价氧化物对应的水化物溶液中逐滴加入XZ3溶液,生成的沉淀X(OH)3的质量随XZ3溶液加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
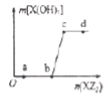
A.d点对应的溶液中:K+、NH4+、CO32-、I-
B.c点对应的溶液中:Ag+、Ca2+、NO3-、Na+
C.b点对应的溶液中:Na+、S2-、SO42-、Cl-
D.a点对应的溶液中:Na+、K+、SO42-、HCO3-
【答案】C
【解析】
试题分析:W、X、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Z是非金属元素,W、X的最高价氧化物对应的水化物可以相互反应生成盐和水,则W为Na元素,X为Al元素;X与Z形成XZ3溶液,则Z为Cl元素.向一定量的NaOH溶液中逐滴加入AlCl3溶液,由图可知,0~b,没有沉淀,溶液中氢氧化钠有剩余,溶液中溶质为氢氧化钠、偏铝酸钠、氯化钠。b点时,氢氧化钠与氯化铝恰好完全反应,溶液中溶质为偏铝酸钠、氯化钠,b~c,沉淀增大,偏铝酸根与铝离子发生双水解反应,生成氢氧化铝沉淀,溶液中溶质为偏铝酸钠、氯化钠,c点时,沉淀达最大,偏铝酸根与铝离子恰好完全反应,溶液中溶质为氯化钠,c点以后,再加入氯化铝,沉淀不变,溶液中溶质为氯化铝、氯化钠。A.d点对应的溶液中含有Al3+,Al3+与C032-发生水解反应生成氢氧化铝沉淀、二氧化碳,不能大量共存,A项错误;B.c点对应的溶液中含有Cl-,Cl-与Ag+反应生成氯化银沉淀,不能大量共存,B项错误;C.b点对应的溶液中偏铝酸钠、氯化钠,离子之间不发生反应,可以大量共存,C项正确;D.a点对应的溶液中含有氢氧化钠、偏铝酸钠、氯化钠,AlO2-与HC03-发生反应生成氢氧化铝沉淀,0H-与HC03-发生反应生成碳酸根与水,不能大量共存,D项错误;答案选C。


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】将钠、镁、铝0.3mol分别放入100 mL 1mol.L-1 的盐酸中,在同温、同压下产生的气体体积比是
A.3:1:1 B.6:3:2 C.1:2:3 D.1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
钒(12V)是我国的丰产元素,广泛用于催化及钢铁工业。回答下列问题:
(1)钒价层电子排布图为 ,比钒质子数大1的元素原子的电子排布式为 。
(2)钒的某种氧化物的晶胞结构如图1所示。晶胞中实际拥有的阴、阳离子个数分别为 、 。
(3)V2O5常用作SO2转化为SO3的转化剂。SO2分子VSEPR模型是 ,硫原子杂化类型为 ;SO3气态为单分子,SO3的三聚体环状结构如图2所示,该结构中S原子的杂化轨道类型为 ;该结构中S——O键长有两类,一类键长约140pm,另一类键长约为160pm,较长的键为 (填图2字母),该分子含有 个σ键。
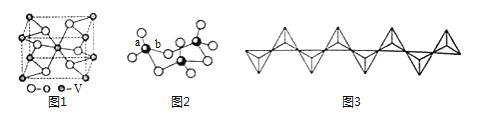
(4)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为 ;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构(钒位于体心),则偏钒酸钠的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊进入患者腹中。明胶是水溶性蛋白质混合物,溶于水形成胶体。由工业明胶制成的胶囊往往含有超标的重金属Cr,从而对人体造成伤害。
①已知Fe(CrO2)2中铬元素是+3价,则其中铁元素是 价。
②CrO2-是一种酸根离子,则Fe(CrO2)2属于__ _(填“酸”、“碱”、“盐”或“氧化物”)。
③明胶的水溶液和K2SO4溶液共同具备的性质是 。
A.都不稳定,密封放置会产生沉淀
B.两者均有丁达尔现象
C.分散质粒子都可通过滤纸
Ⅱ.Cr是一种银白色金属,化学性质稳定,以+3和+6价为常见价态。工业上以铬铁矿(主要成分为FeO·Cr2O3 ,含有Al2O3、SiO2等杂质)为主要原料生产金属铬和重铬酸钠Na2Cr2O7·2H2O(已知Na2Cr2O7是一种强氧化剂),其主要工艺流程如下:
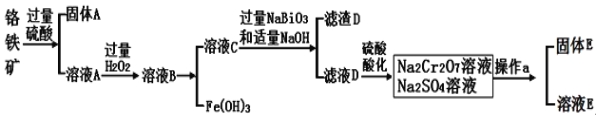
查阅资料:
常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-
(1)工业上常采用热还原法制备金属铬,写出以Cr2O3为原料,利用铝热反应制取金属铬的化学方程式 。
(2)酸化滤液D时,用硫酸而不选用盐酸,可能的原因是 。
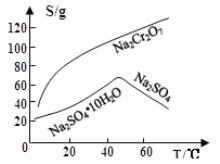
(3)固体E的主要成分是Na2SO4,根据下图分析操作a为 、 。
(4)已知含+6价铬的污水会污染环境。电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-,处理该废水常用还原沉淀法,具体流程如下:

①Cr(OH)3的化学性质与Al(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为 ;(用离子方程式表示)
②下列溶液中可以代替上述流程中Na2S2O3溶液的是 (填选项序号);
A.FeSO4溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.Na2SO3溶液
③上述流程中,每消耗0.1molNa2S2O3转移0.8mole-,则加入Na2S2O3溶液时发生反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )
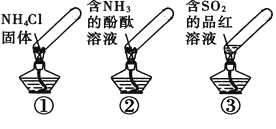
A. 加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好
B. 加热时,②溶液褪色或红色变浅,冷却后又都变为红色
C. 加热时,③溶液褪色或红色变浅,冷却后又都变为红色
D. 三个“封管实验”中所发生的化学反应都是可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关组成生物体细胞的化学元素的叙述正确的是( )
A. 细胞中一种元素的作用能被其他元素替代
B. 细胞中的脱氧核苷酸和蛋白质都不含有氮元素
C. 细胞鲜重中含量前四位的元素与细胞干重含量前四位的元素排序不同,这是因为细胞内水的含量不同
D. 细胞中的微量元素因含量极少而不如大量元素重要
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学方程式可简明地体现元素及其化合物的性质。已知:
氧化还原反应:2FeCl3+2HI=2FeCl2+I2+2HCl;2Co(OH)3+6HCl =2CoCl2+Cl2↑+6H2O;
2Fe(OH)2+ I2+2KOH = 2Fe(OH)3+2KI;3I2+6KOH=5KI+KIO3+3H2O
复分解反应:2HSCN +K2CO3 = 2KSCN + CO2 ↑ + H2O;
KCN + CO2 + H2O = HCN + KHCO3
热分解反应:4NaClO![]() 3NaCl + NaClO4;NaClO4
3NaCl + NaClO4;NaClO4 ![]() NaCl + 2O2↑
NaCl + 2O2↑
下列说法不正确是 ( )
A.酸性(水溶液):HSCN > H2CO3 > HCN
B.还原性(碱性溶液):Fe(OH)2 > I2 > KIO3
C.热稳定性:NaCl > NaClO4 > NaClO
D.氧化性(酸性溶液):FeCl3 > Co(OH)3 > I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某短周期元素X,其原子的电子层数为n,最外层电子数为2n+1。下列有关元素X的说法错误的是( )
A. 元素X不可能是金属元素
B. 元素X的气态氢化物不一定是电解质
C. 元素X一定能形成化学式为KXO3的含氧酸钾盐
D. 工业上制取X的单质时一定采用氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是常规核裂变产物之一,可以通过测定大气或水中
是常规核裂变产物之一,可以通过测定大气或水中![]() 的含量变化来监测核电站是否发生放射性物质泄漏。下列有关
的含量变化来监测核电站是否发生放射性物质泄漏。下列有关![]() 的叙述中错误的是
的叙述中错误的是
A. ![]() 的化学性质与
的化学性质与![]() 相同 B.
相同 B. ![]() 的原子序数为53
的原子序数为53
C. ![]() 的原子核外电子数为78 D.
的原子核外电子数为78 D. ![]() 的原子核内中子数多于质子数
的原子核内中子数多于质子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com