
����Ŀ���ѻӷ��Զ����㣨TaS2���ɲ�������װ���ᴿ����������TaS2��ĩװ��ʯӢ��һ�ˣ�����պ����������Ⲣ��ܣ����ڼ���¯�У���Ӧ���£�TaS2��s��+2I2��g��TaI4��g��+S2��g������˵����ȷ���ǣ� �� ![]()
A.�ڲ�ͬ�¶�����TaI4�������ֲ���
B.���ᴿ�����У�I2�������ϼ���
C.���ᴿ�����У�I2�������ǽ�TaS2�Ӹ�����ת�Ƶ�������
D.�÷�Ӧ��ƽ�ⳣ����TaI4��S2��Ũ�ȳ˻��ɷ���
���𰸡�C
���������⣺A�����ݷ�Ӧ������֪���¶Ȳ�ͬʱ��Ӧ���е���Ҫ����ͬ��TaI4�����ı䣬��A����
B����Ϊ����ͬһ�ܱ�ϵͳ���������غ㶨�ɿ�֪I2���������ܲ��ϼ��٣���һ�������´ﵽƽ����ٱ仯����B����
C�����ᴿ�����У�I2�������dz䵱һ�������˹����Ľ�ɫ����TaS2�Ӹ�����ת�Ƶ��������Դﵽ�ᴿ��Ŀ�ģ���C��ȷ��
D������ƽ�ⳣ������ʽ��֪��ƽ�ⳣ����ƽ��ʱ�������Ũ���ݴη��˻����Է�Ӧ��ƽ��Ũ�ȵ��ݴη��˻�������ƽ�ⳣ��K��Tal4��S2��Ũ�ȳ˻������ȣ���D����
��ѡC��
Ӧ�������Ϣ�еĻ�ѧƽ�⣬���ƽ������ۺ�֪ʶ���з����жϣ�TaS2��s��+2I2��g��TaI4��g��+S2��g���ǻ�ѧƽ�⣬�����㣨TaS2�����ѻӷ������ʣ����ͼʾ�ж������λ�ÿ�֪���ᴿ�ǰѶ����㣨TaS2���͵ⵥ���ڸ����·�Ӧ��������TaI4��g����S2��g�������Ը÷�Ӧ����Ӧ�����ȷ�Ӧ����������ɢ����������ƽ���������ɶ����㣨TaS2����I2��g����ʹ�����㣨TaS2���õ��ᴿ��


 ����ȫ���ִʾ��ƪ��ϵ�д�
����ȫ���ִʾ��ƪ��ϵ�д� �����߿����ϵ�д�
�����߿����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ԭ��Ӧ��2Ag+��aq��+Cu��s���TCu2+��aq��+2Ag��s����Ƶ�ԭ�����ͼ��ʾ����ش��������⣺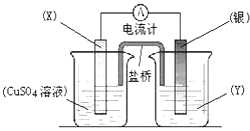
��1���缫X�IJ��������������ҺY����
��2�����缫Ϊ��ص����������ĵ缫��ӦΪ��X�缫�Ϸ����ĵ缫��ӦΪ��
��3�����·�еĵ����Ǵ��缫�����缫��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾʵ��װ�ÿ��Բⶨ���³�ѹ�������Ħ���������ͬѧ������ͼ1װ�ã��������в������ʵ�飺 
��װ���װ�ã��������Լ�飮
����ɰֽ��ȥþ������������Ȼ��ȡ0.108g��þ����
��ȡ��Aƿ���Ͽڵ���Ƥ������С�ձ�����20mLˮ���ٰ��ѳ�����þ���ӵ�Aƿ�ĵײ�������Ƥ���������Ͽڣ�
����ע������Aƿ���Ͽڴ�������ʹBƿ��������Һ���ƽ��
����ע������ȡ10mL3molL��1������Һ������ͷ����Aƿ���Ͽ���Ƥ����������ע��Aƿ��ע���Ѹ�ٰγ���ͷ��
��þ����ȫ��Ӧ��ȡCƿ��Һ����������¼���ݣ�
����ע������Aƿ���Ͽڴ����8.0mL���壬ʹBƿ�е�������Һ���ƽ��
�����Cƿ��Һ�������115.0mL�����������գ�
��1�����³�ѹ�µ�ѹǿΪ �� �¶�Ϊ ��
��2���ڳ��³�ѹ������Ħ���������ֵԼΪ24.5L/mol���� ͬѧ����� ������lmol��������Ϊ �� ����˴�ʵ���������Ϊ%������2λ��Ч���֣�����������ָ���Dz�������ɵľ�������뱻������Լ������ֵ֮�ȣ�����100%���õ���ֵ���ٷ�����ʾ������������Ŀ���ԭ�� ��
a��þ���к�����b��û�г�ȥþ������������c����Ӧ���ȣ�d�����������������
��3����ͬѧ���������ͼ2װ����ɸ�ʵ�飮��װ�������Եļ�鷽���ǣ� ��
��4����ԭ����װ����ȣ���ͬѧʹ�õ�װ��ʵ�龫�ȸ��ߣ���˵�����ɣ��ش������� �� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ����
A.1molH2SO4������Ϊ98g��mol-1B.H2SO4��Ħ������Ϊ98g
C.98gH2SO4����NA��H2SO4����D.6.02��1023��H2SO4���ӵ�����Ϊ9.8g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ӦX��Y��M��NΪ���ȷ�Ӧ���Ը÷�Ӧ������˵������ȷ���ǣ� ��
A.X������һ������MB.��÷�ӦΪ���ȷ�Ӧ���ʲ��ؼ��ȾͿɷ���
C.X��Y��������һ������M��N��������D.Y������һ������N
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ���������ȷ�Ӧ����
A. ��������������ӦB. пƬ��ϡ���ᷴӦ
C. �Ȼ�茶����������������巴ӦD. ������ˮ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭпԭ��أ���ͼ������ʱ��������������ȷ���ǣ� �� 
A.������ӦΪ��Zn��2e���TZn2+
B.��ط�ӦΪ��Zn+Cu2+�TZn2++Cu
C.�����·�У����ӴӸ�����������
D.�����е�K+����ZnSO4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������98%���ܶ�Ϊ1.84g/cm3ŨH2SO4������450mL��0.2mol/L��ϡH2SO4 ��
��1�������㣬��ŨH2SO4�����Ϊ ��
��2�����ձ�������������Ͳ�⣬����������Һ����Ҫ�IJ��������� ��
��3�������ƹ����У�����������ȷ�����в����У�������Ũ��ƫ�ߵ���������ţ���
�ٽ�ŨH2SO4ֱ�ӵ����ձ��������ձ���ע������ˮ��ϡ��ŨH2SO4��
��δ��ϡ�ͺ��H2SO4��Һ��ȴ�����¾�ת�Ƶ�����ƿ�У�
��ϴ���ܽ��õ��ձ��벣����������ϴ��Һת�Ƶ�����ƿ�У�
��ת��ǰ������ƿ�к�����������ˮ��
�ݶ���ʱ�����ӱ��ߣ�
����ҡ�Ⱥ���Һ����ڱ��ߣ����ý�ͷ�ιܼ�����ˮ�����ߣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��vmLAl2(SO4)3��Һ�к�agAl3+��ȡ0.5vmL����Һ����vmLijŨ�ȵ�BaCl2��Һǡ����ȫ��Ӧ����BaCl2��Һ��Ũ��Ϊ
A. 1000a/18Vmol/L B. 1000a/36Vmol/L C. 1000a/18mol/L D. 1000a/36mol/L
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com