
| A. | 二氧化硫的接触氧化在合成塔中发生 | |
| B. | 吸收塔得到的硫酸浓度为98% | |
| C. | 煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失4% | |
| D. | 接触室中适宜条件是V2O5作催化剂、高温、常压 | |
| E. | 接触室中采取高温是为了提高催化剂的活性和提高SO2的转化率 |
分析 A.依据接触法制硫酸的工业流程和三个设备反应分析判断;
B.依据三氧化硫吸收的方法是利用浓硫酸吸收得到发烟硫酸来分析判断;
C.FeS2的损失率与S的损失率是一样的,根据S元素守恒,利用关系式计算;
D.二氧化硫生成三氧化硫的反应是放热的可逆反应,运用平衡移动的原理判断;
E.二氧化硫生成三氧化硫的反应是放热反应,升温向吸热方向移动,即逆方向移动,SO2的转化率会降低.
解答 解:A.依据接触法制硫酸的工业流程和三个设备分析判断,硫铁矿与氧气在沸腾炉中反应生成二氧化硫,二氧化硫的接触氧化是在接触室中发生的,三氧化硫的吸收是在吸收塔中完成的,故A错误;
B.吸收塔是用98.3%的H2SO4来吸收SO3,最终得到“发烟”硫酸,折算成硫酸的浓度只会大于98.3%,故B错误;
C.设黄铁矿m克,含硫为 m×48% 克,设FeS2为 x 克,硫铁矿中硫的含量为$\frac{32×2}{56+32×2}$,根据S元素守恒,利用关系式可看出:
FeS2------------------2S
120 64
x m×48%
比例关系:$\frac{120}{x}$=$\frac{64}{m×48%}$ 解得:x=$\frac{m×48%×120}{64}$,若硫铁矿损失2%,用m表示为:$\frac{m×48%×120}{64}$×2%,这就是损失的硫铁矿,则S损失为:$\frac{m×48%×120}{64}$×2%×$\frac{32×2}{56+32×2}$,
化简得:m×48%×2%,则硫的损失率=$\frac{损失的硫的质量}{硫的总质量}$×100%,代入数据,硫的损失率=$\frac{m×48%×2%}{m×48%}$×100%=2%,FeS2的损失率与S的损失率是一样的,故C错误;
D.接触室中二氧化硫与氧气反应生成三氧化硫是一个可逆反应,正方向放热,选择400℃~500℃的高温,V2O5作催化剂,原因在于此温度催化剂的活性最大,反应速率和平衡转化率都较高,如温度过高,平衡逆向移动,转化率反而降低,常压下,平衡转化率较高,如增大压强,平衡向正方向移动,理论上提高了转化率,但是会造成设备造价和耗能增加,故接触室中适宜条件是V2O5作催化剂、高温、常压,
故D正确;
E.二氧化硫生成三氧化硫的反应是放热的可逆反应,升高温度平衡向吸热方向移动,即逆方向移动,SO2的转化率会降低,故E错误;
故选D.
点评 本题考查了接触法制硫酸的工业流程,损失率的计算以及化学平衡解决化工生产的实际问题,题目难度适中.


 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:解答题
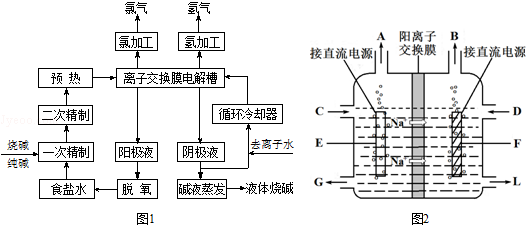
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
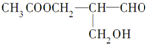 )有光学活性.则该有机化合物分别发生如下反应后,生成的有机物仍有光学活性的是( )
)有光学活性.则该有机化合物分别发生如下反应后,生成的有机物仍有光学活性的是( )| A. | 与乙酸发生酯化反应 | B. | 与NaOH水溶液共热 | ||
| C. | 与银氨溶液作用 | D. | 在催化剂存在下与氢气作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | HPO32-既能电离也能水解 | |
| B. | Na2HPO3溶液一定呈碱性 | |
| C. | H3PO3具有还原性 | |
| D. | H3PO3的溶液中加入过量NaOH,生成Na3PO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用0.1000mol/L NaOH溶液滴定待测H2SO4溶液:
用0.1000mol/L NaOH溶液滴定待测H2SO4溶液:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
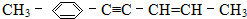 ,共面的碳原子最多有
,共面的碳原子最多有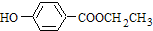 ;
;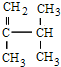 系统法命名的名称为2,3-二甲基-1-丁烯.
系统法命名的名称为2,3-二甲基-1-丁烯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
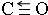 .NH3分子中N原子的杂化方式为SP3杂化,NH3分子的空间立体构型是三角锥型.
.NH3分子中N原子的杂化方式为SP3杂化,NH3分子的空间立体构型是三角锥型.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com