
����Ŀ����CO2ת��Ϊ�״���ԭ��Ϊ CO2��g��+3H2��g��CH3OH��g��+H2O��g����H��0.500��ʱ�������Ϊ1L �Ĺ̶��ݻ����ܱ������г���1mol CO2��3mol H2 �� ���CO2Ũ����CH3OH Ũ����ʱ��ı仯��ͼ��ʾ�����еó��Ľ��۴�����ǣ������� 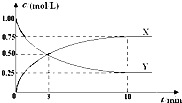
A.����X���Ա�ʾCH3OH��g�� ��H2O��g�� ��Ũ�ȱ仯
B.�ӷ�Ӧ��ʼ��10minʱ��H2�ķ�Ӧ����v��H2��=0.225mol/��L�qmin��
C.ƽ��ʱH2 ��ת����Ϊ75%
D.500��ʱ�÷�Ӧ��ƽ�ⳣ��K=3
���𰸡�D
���������⣺A���淴Ӧ����X��Ũ������X��ʾ������ɷ���ʽ��֪CH3OH��g����H2O��g����Ũ�ȱ仯��ȣ�����X���Ա�ʾCH3OH��g�� ��H2O��g�� ��Ũ�ȱ仯����A��ȷ��
B��Y����ʼŨ��Ϊ1mol/L����Y��ʾ������̼��ƽ��ʱ������̼��Ũ��Ϊ0.25mol/L����v��CO2��= ![]() =0.075mol/��L�qmin��������֮�ȵ��ڻ�ѧ������֮�ȣ���v��H2��=3v��CO2��=3��0.075mol/��L�qmin��=0.225mol/��L�qmin������B��ȷ��
=0.075mol/��L�qmin��������֮�ȵ��ڻ�ѧ������֮�ȣ���v��H2��=3v��CO2��=3��0.075mol/��L�qmin��=0.225mol/��L�qmin������B��ȷ��
C��ƽ��ʱ������̼��Ũ��Ϊ0.25mol/L��������̼��Ũ�ȱ仯��Ϊ1mol/L��0.25mol/L=0.75mol/L���ɷ���ʽ��֪������Ũ�ȱ仯Ϊ3��0.75mol/L=2.25mol/L��������ת����= ![]() ��100%=75%����C��ȷ��
��100%=75%����C��ȷ��
D��ƽ��ʱ������̼��Ũ��Ϊ0.25mol/L����
CO2��g��+ | 3H2��g�� | CH3OH��g��+ | H2O��g�� | |
��ʼ��mol/L�� | 1 | 3 | 0 | 0 |
ת����mol/L�� | 0.75 | 2.25 | 0.75 | 0.75 |
ƽ�⣨mol/L�� | 0.25 | 0.75 | 0.75 | 0.75 |
��ƽ�ⳣ��k= ![]() =5.33����D����
=5.33����D����
��ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Cl2����ijЩ�����л���ʱ�����������HCl�����÷�ӦA��ʵ���ȵ�ѭ�����ã���ӦA��4HCl+O2 ![]() 2Cl2+2H2O ��֪�������������·�ӦA�У�4mol HCl���������ų�115.6kJ��������
2Cl2+2H2O ��֪�������������·�ӦA�У�4mol HCl���������ų�115.6kJ��������
���� ![]()
��д���������£���ӦA���Ȼ�ѧ����ʽ ��
�ڶϿ�1mol H��O����Ͽ�1mol H��Cl�������������ԼΪkJ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ǿ������Һ�У��ܴ����������ɫ���������ǣ� ��
A.K+��Na+��NO3-��Cu2+B.Mg2+��Na+��Cl-��SO42-
C.K+��Na+��Br-��OH-D.Na+��Ba2+��Zn2+��SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�������÷����ɵ�ص�ͭñ��Zn��Cu�ܺ���ԼΪ99%������ͭ���Ʊ�ZnO�IJ���ʵ�������ͼ�� 
��1����д��ͭñ�ܽ������ͭ������Ӧ�Ļ�ѧ����ʽ �� ��ͭñ�ܽ���轫��Һ�й���H2O2��ȥ����ȥH2O2�ļ�㷽���� ��
��2��Ϊȷ������п�ң���Ҫ�ɷ�ΪZn��ZnO������Ϊ�����������������ʵ������ⶨ��ȥH2O2����Һ��Cu2+�ĺ�����ʵ�����Ϊ��ȷ��ȡһ������ĺ���Cu2+����Һ�ڴ�����ƿ�У�������ˮϡ�ͣ�����pH��3��4���������KI����Na2S2O3����Һ�ζ����յ㣮���������е����ӷ���ʽ���£� 2Cu2++4I��=2CuI����ɫ����+I2 I2+2S2O32��=2I��+S4O62��
�ٵζ�ѡ�õ�ָʾ��Ϊ �� �ζ��յ�۲쵽������Ϊ ��
�����ζ�ǰ��Һ��H2O2û�г���������õ�Cu2+�ĺ����������ƫ�ߡ�����ƫ�͡��������䡱����
��3����֪pH��11ʱZn��OH��2������NaOH��Һ����[Zn��OH��4]2�� �� �±��г��˼������������������������pH����ʼ������pH����������Ũ��Ϊ1.0molL��1���㣩
Fe3+ | Fe2+ | Zn2+ | |
��ʼ������pH | 1.1 | 5.8 | 5.9 |
��ȫ������pH | 3.2 | 8.8 | 8.9 |
ʵ���п�ѡ�õ��Լ���30% H2O2��1.0molL��1HNO3��1.0molL��1 NaOH��
�ɻ���ͭ�����Һ�Ʊ�ZnO��ʵ�鲽������Ϊ��
������Һ�м����Թ��� �� ʹ���ַ�Ӧ
����Ӧ�����Һ�еμ�1.0moLL��1��NaOH��Һ��������Һ��pH��ΧΪ��
�۹��ˣ�
������Һ�еμ�1.0moLL��1���������ƣ�����pH��ΧΪ��
�ݹ��ˡ�ϴ�ӡ�����
��900�����գ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ȣ�ClO2��Ϊһ�ֻ���ɫ���壬�ǹ����Ϲ��ϵĸ�Ч�����ס����١���ȫ��ɱ����������Ŀǰ�ѿ������õ�ⷨ��ȡClO2���¹��գ� 
��1������ͼװ����ʯī���缫����һ�������µ�ⱥ��ʳ��ˮ��ȡClO2 �� д����������ClO2�ĵ缫��Ӧʽ�� �� �ڵ��һ��ʱ�䣬�������������������Ϊ112mL����״����ʱ��ֹͣ��⣮ͨ�������ӽ���Ĥ�������ӵ����ʵ���Ϊmol��
��2��Ϊ��״�ȼ�ϵ������ʣ���ѧ�ҷ�����һ��ȼ�ϵ�أ���ص�һ���缫ͨ���������һ���缫ͨ��״����壬������Dz�����Y2O3��ZrO2���壬�ڸ��������ܴ���O2�����ӣ���ع���ʱ������ӦΪ ��
��3�����Ըõ��Ϊ��Դ����ʯī���缫���100mL�����������ӵ���Һ��
���� | Cu2+ | H+ | Cl�� | SO42�� |
c/molL��1 | 1 | 4 | 4 | 1 |
���һ��ʱ��������ռ�����ͬ�������ͬ������������ʱ��������Һ����ı仯���缫������ܴ��ڵ��ܽ������������ռ������������ʵ���Ϊmol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�0.1molL��1CH3COONa��ҺpH=11�����б�����ȷ���ǣ�������
A.c��Na+��=c��CH3COO����
B.c��CH3COO����+c��CH3COOH��=0.1 molL��1
C.��ˮ���������c��OH����=1.0��10��11 molL��1
D.������Һ�м���0.05 molL��1��CH3COONa��pHֵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£�ˮ��Һ��H+��OH����Ũ�ȱ仯������ͼ������˵����ȷ���ǣ������� 
A.�����¶ȣ�����������c��b�ı仯
B.���¶��£�ˮ�����ӻ�����Ϊ1.0��10��13
C.���¶��£�����FeCl3����������b��a�ı仯
D.���¶��£�ϡ����Һ����������c��d�ı仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��FΪԭ���������������ǰ36��Ԫ��������ֻ�����ֽ���Ԫ�ء�A��Cͬ������B��Eͬ������B��C���γ����ֳ�����������C��F�����ֻ��1�����ӣ����ڲ������������̬Dԭ�ӳɶԵ�������δ�ɶԵ�������4����
���ʴ��������}:
��1����̬Bԭ�ӵĹ������ʽΪ______��������ܼ��ĵ�������_____����ͬ����չ������
��2��B��C��Eԭ�Ӱ뾶�ɴ�С��˳��Ϊ_________(��Ԫ�ط��ű�ʾ)��
��3��D��E�е�һ�����ܽϴ����_______(��Ԫ�ط���)��ԭ��Ϊ___________��
��4��A��B�γɵ���������A��E�γɵ����������۵�______(����������������)��ԭ��Ϊ___________��
��5��D������������Ӧ��ˮ��������Dԭ�ӵ��ӻ��������Ϊ______����֪�÷����г���������ԭ�Ӿ����������8�����ȶ��ṹ������ṹʽΪ________��
��6������F����ͬ��Ԫ��P��Q�Ķѻ�ģ�;�Ϊ�����������ܶѻ�������ԭ�ӵİ뾶�ֱ�Ϊ128pm��144pm��144pm������P��Q�����ԭ�������ֱ�ΪM��(P)��M��(Q)��
������F�е���λ��Ϊ______���ܶ�Ϊ_____g/cm3(��NA��ʾ�����ӵ�������ֵ����ʽ����)��
������P��Q���ܶ�֮��Ϊ________[�ú�M��(P)��M��(Q)�Ĵ���ʽ��ʾ]��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ��ʽ���ڱ���һ���֣����еı�Ŵ�����Ӧ��Ԫ�أ� 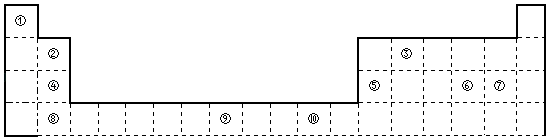
��ش��������⣺
��1���ۺ͢��γɵ�һ��5��10���ӷ��ӣ������幹��Ϊ �� ����ԭ���ӻ���ʽΪ �� �������ӣ�����ԡ��Ǽ��ԡ�����
��2��Ԫ�آۺ͢ߵ�����������Ӧˮ���������Խ�ǿ���ǣ����ѧʽ��Ԫ�آĵ縺��Ԫ�آߣ�ѡ���������=����������=���ĵ縺�ԣ�
��3������Ԫ�����ڱ�������Ԫ�آ�λ���������̬ԭ�ӵ����Ų�ʽΪ ��
��4��ijЩ��ͬ��Ԫ�ص�����Ҳ��һ���������ԣ����ϱ���Ԫ�آ���Ԫ�آݵ��������������Ƶ����ʣ���д��Ԫ�آڵ�����������NaOH��Һ��Ӧ�����ӷ���ʽ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com