
| A、将SO2通入BaCl2溶液中至饱和,无沉淀产生,再通入SO2,产生沉淀 |
| B、称取等质量的两份铝粉,分别加入过量的稀盐酸和过量的NaOH溶液,充分反应后放出氢气的体积(同温同压下)相等 |
| C、向NaHCO3溶液中滴入Ba(OH)2溶液无沉淀,而向Na2CO3溶液中滴入Ba(OH)2溶液出现白色沉淀 |
| D、某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,产生白色沉淀,则原溶液中一定含有SO42- |


科目:高中化学 来源: 题型:
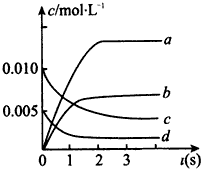 在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表所示
在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表所示
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| N(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、热稳定性:HCl>HI |
| B、原子半径:Na>Mg |
| C、酸性:H2SO3>H2SO4 |
| D、结合质子能力:S2->Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸亚铁加过氧化氢溶液:Fe2++H2O2+2H+═Fe3++4H2O |
| B、将少量硝酸银溶液滴入氨水中:Ag++2NH3?H2O═[Ag(NH3)2]++2H2O |
| C、KAl(SO4)2中滴加Ba(OH)2使SO42-恰好完全沉淀2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
| D、铝粉与NaOH的D2O溶液反应:2Al+2OH-+2D2O═2AlO2-+H2↑+2D2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA |
| B、将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积约为22.4L |
| C、在反应KClO4+8HCl═KCl+4Cl2↑+4H2O中,每生成4mol Cl2转移的电子数为8NA |
| D、25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2012年3月中国公布发现可采页岩气(从页岩层中开采出来的天然气)为25.1万亿立米,可供中国使用近200年.因此大力开发页岩气,做液化石油气的原料,前景可观 |
| B、红宝石、玛瑙、水晶、钻石等装饰品的主要成分都是硅酸盐 |
| C、神七宇航员所穿出仓航天服是由我国自行研制的新型“连续纤维增韧”航空材料做成,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料 |
| D、雾霾天气的造成与PM2.5指数有着重要的关系,PM2.5是指大气中直径小于或等于2.5pm(皮米)的颗粒物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酒精的燃烧热△H=-Q3 kJ?mol-1 |
| B、由③可知1mol C2H5OH(g)的能量高于2mol CO2(g)和3mol H2O(g)的总能量 |
| C、H2O(g)→H2O(l)释放出了热量,所以该过程为放热反应 |
| D、23g液体酒精完全燃烧生成CO2(g)和H2O(l),释放出的热量为(0.5Q3-0.5Q2+1.5Q1)kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
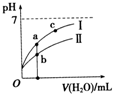 已知下表为250C时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )
已知下表为250C时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
| A、相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:C(Na+)>C(ClO-)>C(CH3COO-)>C(OH-)>C(H+) |
| B、向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO32- |
| C、a、b、c三点所示溶液中水的电离程度c>a>b |
| D、图象中,I表示CH3COOH,Ⅱ表示HClO,且溶液导电性:c>b>a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com