
【题目】次磷酸![]() 是一种精细磷化工产品,具有较强还原性,
是一种精细磷化工产品,具有较强还原性,![]() 可用电渗析法制备。“四室电渗析法”工作原理如图所示
可用电渗析法制备。“四室电渗析法”工作原理如图所示![]() 阳膜和阴膜分别只允许阳离子、阴离子通过
阳膜和阴膜分别只允许阳离子、阴离子通过![]() ,回答下列问题:
,回答下列问题:

![]() 写出阳极的电极反应式:________。
写出阳极的电极反应式:________。
![]() 请判断离子交换膜类型:A________,B________。
请判断离子交换膜类型:A________,B________。![]() 填“阴膜”或“阳膜”
填“阴膜”或“阳膜”![]()
![]() 早期采用“三室电渗析法”制备
早期采用“三室电渗析法”制备![]() :将“四室电渗析法”中阳极室的稀硫酸用
:将“四室电渗析法”中阳极室的稀硫酸用![]() 稀溶液代替,并撤去阳极室与产品室之间的离子交换膜,从而合并了阳极室与产品室。其缺点是产品中混有________杂质,该杂质产生的原因是________。
稀溶液代替,并撤去阳极室与产品室之间的离子交换膜,从而合并了阳极室与产品室。其缺点是产品中混有________杂质,该杂质产生的原因是________。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】根据方程式所表示的氧化还原反应设计一个原电池:Fe + H2SO4 = H2↑+ FeSO4
(1)装置采用烧杯和盐桥,画出此原电池的装置图______________
(2)指出原电池的正极材料和负极材料并标出电子的流向:正极材料_________,负极材料________ ,电子的流向_________
(3)写出两个电极上的电极反应并指出现象:负极反应 ___________ 、现象___________正极反应___________、现象_________________
(4)转移的电子数为2NA时,生成的H2在标准状况下的体积为________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度不变、恒容的容器中进行反应2HI![]() H2+I2(正反应为吸热反应),反应物的浓度由0.1 mol/L降到0.06 mol/L,需要20 s,那么由0.06 mol/L降到0.036 mol/L所需时间为( )
H2+I2(正反应为吸热反应),反应物的浓度由0.1 mol/L降到0.06 mol/L,需要20 s,那么由0.06 mol/L降到0.036 mol/L所需时间为( )
A.等于10 sB.等于12 sC.大于12 sD.小于12 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:图甲是由某温度下![]() 、
、![]() 分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化图.图乙是常温下向100mL
分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化图.图乙是常温下向100mL![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液,混合溶液的pH变化图.如图所示与推测的结论相符的是
溶液,混合溶液的pH变化图.如图所示与推测的结论相符的是
图甲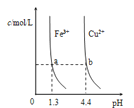 图乙
图乙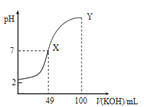
A.由图甲知:![]()
B.由图甲知:a、b点溶液中![]() ,b点的大
,b点的大
C.由图乙知:HA为强酸
D.由图乙知:Y点对应的溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用还原沉淀法处理含铬废水(Cr2O72-和CrO42-),其流程为
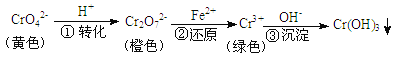
步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq) Ksp=c(Cr3+)c3(OH-)=10-32,下列有关说法正确的是
Cr3+(aq)+3OH-(aq) Ksp=c(Cr3+)c3(OH-)=10-32,下列有关说法正确的是
A.步骤①中当v(CrO42-)=2v(Cr2O72-)时,说明反应:2CrO42-+2H+ ![]() Cr2O72- +H2O达到平衡状态
Cr2O72- +H2O达到平衡状态
B.若向K2Cr2O7溶液中加NaOH浓溶液,溶液可由黄色变橙色
C.步骤②中,若要还原1 mol Cr2O72- 离子,需要12 mol的Fe2+
D.步骤③中,当将溶液的pH 调节至5 时,可认为废水中的铬元素已基本除尽
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求书写下列反应的方程式:
(1)NO2 溶于水的化学反应方程式:_____。
(2)实验室制取氨气的化学反应:_____。
(3)足量的 SO2 气体通入到 NaOH 中的离子反应方程式:______________。
(4)红热的碳和浓硝酸的化学反应方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下铁可以和 CO2 发生反应:Fe(s)+CO2(g)FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的 CO2 气体,反应过程中 CO2 气体和 CO 气体的浓度与时间的关系如图所示:

(1)t1 时,正、逆反应速率的大小关系为 v 正_____v 逆(填“>”“<”或“=”)。
(2)4 min 内,CO 的平均反应速率 v(CO)=_____。
(3)下列条件的改变能减慢其反应速率的是_____(填序号,下同)。
①降低温度
②减少铁粉的质量
③保持压强不变,充入 He 使容器的体积增大
④保持容积不变,充入 He 使体系压强增大
(4)下列描述能说明上述反应已达平衡状态的是_____。
①v(CO2)=v(CO)
②单位时间内生成 n mol CO2 的同时生成 n mol CO
③容器中气体压强不随时间变化而变化
④容器中气体的平均相对分子质量不随时间变化而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国传统文化中蕴含着丰富的化学知识。下列![]() 天工开物
天工开物![]() 的记载中不涉及合金的是
的记载中不涉及合金的是![]()
![]()
A.凡铸镜,模用灰沙,铜用锡和
B.凡倭铅![]() 锌
锌![]() 古书本无之,乃近世所立名色。其质用炉甘石
古书本无之,乃近世所立名色。其质用炉甘石![]() 主要成分为碳酸锌
主要成分为碳酸锌![]() 熬炼而成
熬炼而成
C.凡釜储水受火,日用司命系焉。铸用生铁或废铸铁器为质
D.凡治地生物,用锄、镈之属,熟铁锻成,熔化生铁淋口,入水淬健,即成刚劲
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com