
 如图所示,若电解5min时铜电极增重2.16g,试回答:
如图所示,若电解5min时铜电极增重2.16g,试回答:分析 (1)由铜电极的质量增加,则Cu电极为阴极,可知X为电源的负极,C中阴极反应为Ag++e-═Ag,阳极反应为Ag-e-═Ag+,溶液浓度不变,C是电镀池;
(2)A池是生成碱放氢型,B中电解硫酸铜溶液生成硫酸,pH减小,根据C中电极反应判断;
(3)根据电极反应及电子守恒来计算;
(4)根据A中的电极反应及与C中转移的电子守恒来计算.
解答 解:(1)由铜电极的质量增加,发生Ag++e-═Ag,则Cu电极为阴极,Ag为阳极,Y为正极,可知X为电源的负极,C中阴极反应为Ag++e-═Ag,阳极反应为Ag-e-═Ag+,溶液浓度不变,C是电镀池,故答案为:负极;电镀;
(2)A池是生成碱放氢型,所以pH增大,B中电解硫酸铜溶液生成硫酸,溶液中氢离子浓度增大,pH减小,C中阴极反应为Ag++e-═Ag,阳极反应为Ag-e-═Ag+,溶液浓度不变,则pH不变,
故答案为:增大;减小;不变;
(3)C中阴极反应为Ag++e-═Ag,n(Ag)=$\frac{2.16g}{108g/mol}$=0.02mol,则转移的电子为0.02mol,此时B中的铜离子刚好都放电,所以硫酸铜的物质的量为0.01mol,
通电前c(CuSO4)=$\frac{0.01mol}{0.1L}$=0.1 mol•L-1;
答:电前硫酸铜溶液的物质的量浓度是0.1mol•L-1;
(4)由A中发生2KCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2KOH+H2↑+Cl2↑~2e-,
由电子守恒可知,转移0.02mol电子时生成0.02molKOH,忽略溶液体积的变化,
则c(OH-)=$\frac{0.02mol}{0.2L}$=0.1mol•L-1,溶液pH=13,
答:溶液的pH是13.
点评 本题考查电解原理,侧重于学生的分析能力和计算能力的考查,为高考高频考点,难度中等,注意把握离子的放电顺序,为解答该题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 1L pH=1的乙酸溶液中H+数小于0.1NA | |
| B. | 标准状况下,22.4L乙醇的分子数为NA | |
| C. | 28g乙烯和丙烯所含碳氢键的数目为4NA | |
| D. | 1 mol 甲基所含的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂能发生水解反应生成甘油和高级脂肪酸 | |
| B. | 淀粉和纤维素水解的最终产物都是麦芽糖 | |
| C. | 葡萄糖能与新制Cu(OH)2悬浊液反应产生砖红色沉淀 | |
| D. | 蛋白质在浓硝酸作用下能发生颜色反应,可用来鉴别部分蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 某烷烃的名称为2,2,4,4-四甲基-3,3,5-三乙基己烷 | |
| B. | 顺-2-丁烯与反-2-丁烯与氢气加成的产物不相同 | |
| C. | 聚合物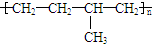 可由单体CH3CH=CH2和CH2=CH2加聚制得 可由单体CH3CH=CH2和CH2=CH2加聚制得 | |
| D. | 等质量的甲醛与乳酸[CH3CH(OH)COOH]完全燃烧消耗氧气的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向盐酸中滴加氨水:H++OH-═H2O | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | 次氯酸钠溶液中通入二氧化硫气体:2ClO-+SO2+H2O═2HClO+SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
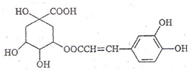
| A. | 分子式为C16H18O9 | |
| B. | 在一定条件下能发生消去反应 | |
| C. | 1mol咖啡鞣酸水解时可消耗8molNaOH | |
| D. | 与浓溴水既能发生取代反应又能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同主族元素自上而下,得电子能力增强 | |
| B. | 最外层电子数小于4的一定是金属元素 | |
| C. | 同周期元素中ⅠA族元素的原子半径最小 | |
| D. | 酸性:HClO4>H2SO4>H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池是新型的绿色环保电池 | |
| B. | 当电路中转移0.2mol电子时,消耗的H2SO4为0.2 mol | |
| C. | 铅蓄电池放电时负极质量减小,正极质量增加 | |
| D. | 铅蓄电池放电时电子由负极经过溶液定向移动到正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com