
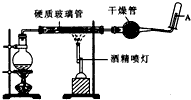
 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”. 请回答该实验中的问题.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”. 请回答该实验中的问题.分析 (1)对于铁与水蒸气反应的化学方程式,教材中已出现,很容易写出化学方程式.还原剂的判定方法根据化合价升高的物质,氧化剂是化合价降低的物质;根据3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe 3O4+4 H2;方程式中反应3mol铁原子转移8个电子.
(2)反应物为水蒸气与铁;放碎瓷片的目的是防止沸腾事故发生;
解答 解:(1)铁与水蒸气发生氧化还原反应:3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe 3O4+4 H2,根据化合价升降来判断氧化剂和还原剂.因铁的化合价升高,所以铁作还原剂,水中氢的化合价降低,水作氧化剂;根据3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe 3O4+4 H2;方程式中反应3mol铁原子转移8个电子,设转移电子物质的量为X,
3Fe≈8e-
3×56 8
8.4g x
$\frac{3×56}{8.4g}$=$\frac{8}{x}$,解得:x=0.4mol,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe 3O4+4 H2;H2O;Fe;0.4;
(2)因为反应物为水蒸气与铁,所以这里加热的目的就是提供水蒸气,烧瓶底部应事先放置碎瓷片,放碎瓷片的目的是防止沸腾事故发生,
故答案为:为实验提供水蒸气;碎瓷片;防止暴沸.
点评 本题考查了物质的制备、物质成分的探究实验,题目侧重于考查学生的实验探究能力,注意把握铁及其化合物的性质以及铁离子的检验方法,题目难度不大,电子数计算是本题的难点.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
 常温下,将Cl2缓慢通入水中至饱和,然后向其中滴加0.1mol/LKOH溶液.整个实验过程溶液中c(OH-)的变化曲线如图所示,不考虑次氯酸分解,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向其中滴加0.1mol/LKOH溶液.整个实验过程溶液中c(OH-)的变化曲线如图所示,不考虑次氯酸分解,下列叙述正确的是( )| A. | a点对应溶液中含有的分子有H2O、HClO、HCl、Cl2 | |
| B. | b点对应溶液中:c(H+)>c(Cl-)>c(HClO)>c(ClO-)>c(OH-) | |
| C. | c点对应溶液中:c(K+)=c(Cl-)+c(ClO-)+c(HClO) | |
| D. | 实验过程中可以用pH试纸测定溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2SO4 | B. | H2SO4 | C. | Ba(OH)2 | D. | AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电源的负极就是阴极 | |
| B. | 与直流电源正极相连的是电解池的阴极 | |
| C. | 与直流电源负极相连的电极上发生还原反应 | |
| D. | 阳极上发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
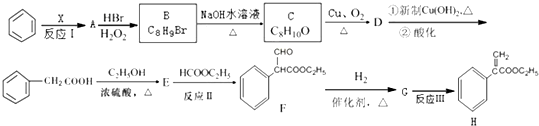
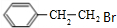 ;E的分子式为C10H12O2;F中含氧官能团的名称是醛基、酯基.
;E的分子式为C10H12O2;F中含氧官能团的名称是醛基、酯基. .
.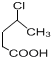 制备
制备 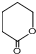 的合成路线流程
的合成路线流程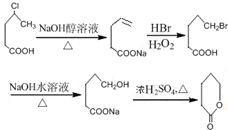 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H3PW12O40在该酯化反应中起催化作用 | |
| B. | 杂多酸盐Na2HPW12O40与Na3PW12O40都是强电解质 | |
| C. | H3PW12O40、KH2PW12O40与Na3PW12O40中含有的原子团不同 | |
| D. | 硅钨酸H4SiW12O40也是一种杂多酸,其中W的化合价为+6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
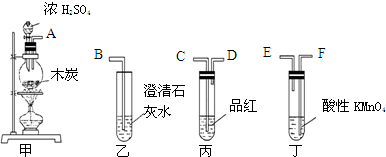
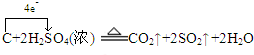 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com