
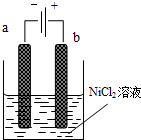
 三氧化二镍(Ni2O3)可用于制造高能电池.一种制备Ni2O3的方法是电解NiCl2得Ni3+,再将Ni3+经一系列反应后转化为Ni2O3.其电解制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解.电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍.如图为电解装置示意图,电解池两极用阳离子交换膜隔开.请回答下列问题:
三氧化二镍(Ni2O3)可用于制造高能电池.一种制备Ni2O3的方法是电解NiCl2得Ni3+,再将Ni3+经一系列反应后转化为Ni2O3.其电解制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解.电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍.如图为电解装置示意图,电解池两极用阳离子交换膜隔开.请回答下列问题:| 放电 |
| 充电 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaCl HCl H2SO4 AgNO3 |
| B、CuSO4 NaOH BaCl2 HCl |
| C、KCl HCl NaOH BaCl2 |
| D、NaOH KOH MgCl2 H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2的水解产物是NaOH和H2O2 |
| B、NaClO的水解产物之一是HClO |
| C、CCl4的水解产物是CH4和HClO |
| D、CaC2的水解生成C2H2和Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(2a-1.6)g |
| B、2(a-1.6)g |
| C、(a-1.6)g |
| D、3.2 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 由于工业发展,燃烧设备不断增多,设备规模不断增大.这些工厂排放的烟气中都会有大量的SO2废气.据统计,我国1995年工业SO2的排放量为1396万吨,2006年工业SO2的排放量达到了3800万吨,由于SO2的污染,我国每年损失高达1100亿元.
由于工业发展,燃烧设备不断增多,设备规模不断增大.这些工厂排放的烟气中都会有大量的SO2废气.据统计,我国1995年工业SO2的排放量为1396万吨,2006年工业SO2的排放量达到了3800万吨,由于SO2的污染,我国每年损失高达1100亿元.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com