
通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)。SiC____________Si;SiCl4____________SiO2。
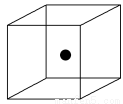
(2)下图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子。
(3)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g) Si(s)+4HCl(g)该反应的反应热ΔH=________ kJ·mol-1。
Si(s)+4HCl(g)该反应的反应热ΔH=________ kJ·mol-1。
(1)> <
(2)如下图

(3)236
【解析】(1)SiC和晶体Si皆为原子晶体,由于碳化硅晶体中的Si—C键的键能大于硅晶体中Si—Si键的键能,故SiC的熔点比Si高;SiCl4为分子晶体,SiO2为原子晶体,故SiCl4的熔点比SiO2低。
(2)晶体硅的结构与金刚石相似,每个硅原子都被相邻的4个硅原子包围,这4个硅原子位于四面体的四个顶点上,被包围的硅原子处于正四面体的中心。
(3)根据题目所给反应式,需要断裂的旧化学键键能之和为4×360 kJ·mol-1+2×436 kJ·mol-1=2 312 kJ·mol-1,形成的新化学键键能之和为4×431 kJ·mol-1+2×176 kJ·mol-1=2 076 kJ·mol-1,所以ΔH=236 kJ·mol-1。


科目:高中化学 来源:2014年高二鲁科选修3化学规范训练2.4分子间作用力物质性质练习卷(解析版) 题型:简答题
在下列各组气体中,试分析判断哪种气体更易液化?
①Cl2、N2;②SiH4、CH4;③SO2、CO2;④邻二甲苯、对二甲苯;⑤甲烷、乙烷;⑥丁烷、异丁烷
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练2章化学键分子间作用力练习卷(解析版) 题型:选择题
下列有关共价键的叙述中,不正确的是( )。
A.某原子跟其他原子形成共价键时,其共价键数一定等于该元素原子的价电子数
B.水分子内氧原子结合的电子数已经达到饱和,故不能再结合其他氢原子
C.非金属元素原子之间形成的化合物也可能是离子化合物
D.所有简单离子的核电荷数与其核外电子数一定不相等
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练2.2.1典型分子空间构型练习卷(解析版) 题型:选择题
如图在乙烯分子中有5个σ键、一个π键,它们分别是( )。
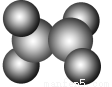
A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键
B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
C.C—H之间是sp2形成的σ键,C—C之间是未参加杂化的2p轨道形成的π键
D.C—C之间是sp2形成的σ键,C—H之间是未参加杂化的2p轨道形成的π键
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 3.3原子晶体与分子晶体练习卷(解析版) 题型:选择题
下列化合物按其晶体的熔点由高到低排列正确的是( )。
A.SiO2 CsCl CBr4 CF4
B.SiO2 CsCl CF4 CBr4
C.CsCl SiO2 CBr4 CF4
D.CF4 CBr4 CsCl SiO2
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 3.2金属晶体与离子晶体练习卷(解析版) 题型:填空题
今有aX、bY、cZ三种元素。已知:①各原子序数a、b、c均小于20且a+b+c=25;②元素Y的原子外围电子构型为ns2npn+2;③X和Y在不同条件下可形成X2Y和X2Y2两种化合物,Y和Z在不同条件下可形成ZY和ZY2两种化合物;④Z的硫化物的相对分子质量与Z的氯化物的相对分子质量之比为38∶77,据上可推知:
(1)X________,Y________,Z________(写元素符号)。
(2)X2Y2是________晶体,构成晶体的微粒是________,该晶体中含有________(填其微粒间作用)。
(3)Z的硫化物和氯化物的分子空间构型分别是__________、________,其中Z原子分别以________、________杂化轨道成键,按照成键方式来分类,Z的硫化物中的共价键类型和数目是___________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 3.2金属晶体与离子晶体练习卷(解析版) 题型:选择题
下列有关金属键的叙述错误的是( )。
A.金属键没有饱和性和方向性
B.金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用
C.金属键中的电子属于整块金属
D.金属的性质和金属固体的形成都与金属键有关
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 2.1.2键参数练习卷(解析版) 题型:选择题
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中1 mol H—H键断裂时吸收热量为( )。
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 6专题综合检测练习卷(解析版) 题型:填空题
锌锰废电池经处理后,生产并回收硫酸锌及碳酸锰,其中生产工业级碳酸锰工艺如下:
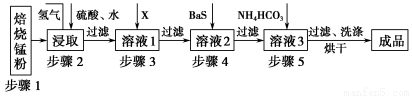
试回答下列问题:
(1)锰在元素周期表中位于第________周期,第________族。
(2)步骤1和步骤2是将MnO2转化为MnO并溶于硫酸,其中步骤2中的氢气,是另一个流程产生的副产品,请写出产生氢气的反应方程式__________________________。
(3)步骤3和步骤4都是除杂质。
①X是一种“绿色”氧化剂,则X是________(填化学式)。
②步骤3是除去杂质Fe2+。请用文字和必要的方程式简述除去Fe2+的方法(已知三种离子沉淀的pH范围为Fe3+:2.7~3.7,Mn2+:8.6~10.1,Fe2+:7.6~9.6)_________________________________________________________。
③步骤4中主要反应方程式为:MeSO4+BaS=MeS↓+BaSO4↓(Me主要为Pb、Cd、Hg等),则其除去杂质的原理是_________________________________________________。
(4)已知进行步骤5的操作时,溶液3(主要成分为MnSO4)会产生大量无色无味的气泡,则步骤5反应的化学方程式为_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com