
| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | 3v逆(C)=2v正(B) | D. | 气体的平均相对分子质量 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、反应前后两边气体计量数相等,所以体系的压强始终不变,所以不能说明反应达平衡状态,故A选;
B、混合气体的密度,容器内气体的质量不变,说明反应达平衡状态,故B不选;
C、3v逆(C)=2v逆(B)=2v正(B),所以正逆反应速率相等,反应达平衡状态,故C不选;
D、反应前后两边气体计量数相等,气体的平均相对分子质量不变,则容器内气体的质量不变,说明反应达平衡状态,故D不选;
故选A.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 金刚石晶体中的最小碳原子环由6个碳原子构成 | |
| B. | 金刚石晶体中的碳原子是sp2杂化的 | |
| C. | 12g金刚石中含有C-C键的个数为4NA | |
| D. | 金刚石化学性质稳定,即使在高温下也不会和O2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙烯气相直接水合反应,在其他条件相同时,分别测得C2H4的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如图.结合曲线归纳平衡转化率
乙烯气相直接水合反应,在其他条件相同时,分别测得C2H4的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如图.结合曲线归纳平衡转化率查看答案和解析>>
科目:高中化学 来源: 题型:解答题
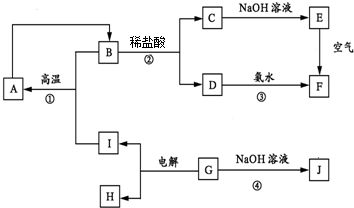
 ,E的化学式为Fe(OH)2.
,E的化学式为Fe(OH)2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
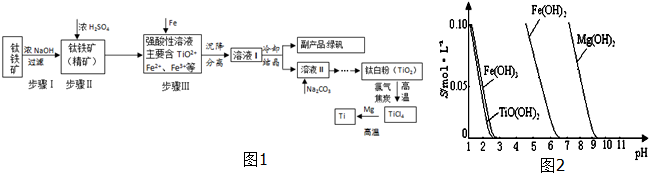
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
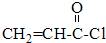 $→_{反应③}^{CH_{3}CH_{2}OH}$CH2=CH-COOCH2CH3
$→_{反应③}^{CH_{3}CH_{2}OH}$CH2=CH-COOCH2CH3 .(注明反应条件)
.(注明反应条件) 或CH2=CH-O-CH2-O-CH=CH2.
或CH2=CH-O-CH2-O-CH=CH2.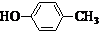 也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为
也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为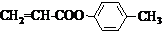 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
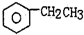 (g)$\stackrel{560℃}{?}$
(g)$\stackrel{560℃}{?}$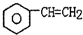 (g)+H2(g)△H<0
(g)+H2(g)△H<0| A. | 加入适当催化剂,可以提高乙苯的转化率 | |
| B. | 在保持体积一定的条件下,充入较多的乙苯,可以提高乙本的转化率 | |
| C. | 在加入乙苯至达到平衡过程中,混合气体的平均相对分子质量不变 | |
| D. | 仅从平衡移动的角度分析,工业生产苯乙稀选择恒压条件优于恒容条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ③④ | C. | ①②③ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4+2NaOH═Cu(OH)2↓+Na2SO4 | B. | Cl2+H2O?HCl+HClO | ||
| C. | Zn+H2SO4═ZnSO4+H2↑ | D. | 2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com