
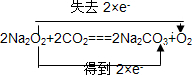 .
.分析 由方程式可知反应中只有O元素的化合价发生变化,反应中Na2O2既是氧化剂又是还原剂,根据化合价的变化判断电子转移的数目.
解答 解:(1)在 2Na2O2+2CO2═2Na2CO3+O2反应中,只有Na2O2中O元素的化合价发生变化,分别由-1价变化为0价和-2价,用双线桥法可表示为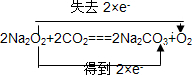 ,故答案为:
,故答案为: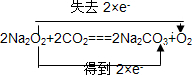 ;
;
(2)只有Na2O2中O元素的化合价发生变化,反应中Na2O2既是氧化剂又是还原剂,故答案为:Na2O2;Na2O2;
(3)由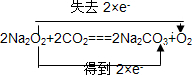 可知若转移3mol电子,则所产生的氧气为1.5mol,体积为1.5mol×22.4L/mol=33.6L,
可知若转移3mol电子,则所产生的氧气为1.5mol,体积为1.5mol×22.4L/mol=33.6L,
故答案为:33.6L.
点评 本题考查氧化还原反应,题目难度不大,解答该类题目的关键是能把握元素的化合价的变化,注意用双线桥法书写电子转移方向和数目的方法.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 淀粉溶液中滴入碘水--变蓝色 | B. | 溴化银见光分解--变黑色 | ||
| C. | 苯酚溶液中滴入Fe 3+--变紫色 | D. | 胆矾空气中久置--变白色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
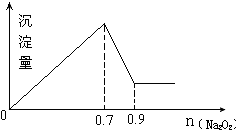
| A. | 1:3 | B. | 2:3 | C. | 6:1 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
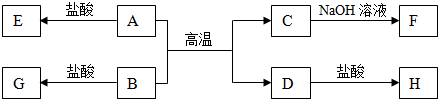
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.25 mol•L-1 | B. | 0.025 mol•L-1 | C. | 0.5 mol•L-1 | D. | 0.125 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 活泼金属在空气中易与氧气反应,都能在其表面形成一层致密的氧化膜 | |
| B. | 钠比铜的活泼性强,所以钠投入到CuSO4溶液中可置换出单质铜 | |
| C. | 等质量的铝粉分别与足量的盐酸或NaOH溶液完全反应时,产生的气体质量相等 | |
| D. | 用铁制或铝制容器来盛装浓硝酸,是因为Fe或Al不能与冷的浓硝酸发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com