
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,2.24L正戊烷中含有的碳原子数为0.5 NA
B. 1L0.1mol·L-1NaHCO3溶液中所含HCO3-的数目为0.1NA
C. 一定条件下,0.1mol CO与0.1mol H2O(g)充分反应,生成H2的分子数为0.1NA
D. 在反应:3FeS2+12C+8O2=Fe3O4+12CO+6S中,每生成0.6molS,转移的电子数为3.2NA
【答案】D
【解析】A项,正戊烷在标准状况下不呈气态,不能用22.4L/mol计算正戊烷分子物质的量;B项,HCO3-在溶液中既存在电离平衡又存在水解平衡;C项,CO与H2O(g)生成CO2和H2的反应为可逆反应;D项,反应中S元素的化合价由-1价升至0价,C元素的化合价由0价升至+2价,Fe元素的化合价部分由+2价升至+3价(Fe3O4可写成FeO·Fe2O3),O元素的化合价全由0价降至-2价,生成6molS,转移32mol电子。
A项,正戊烷在标准状况下不呈气态,不能用22.4L/mol计算正戊烷分子物质的量,A项错误;B项,n(NaHCO3)=0.1mol/L![]() 1L=0.1mol,HCO3-在溶液中既存在电离平衡又存在水解平衡,溶液中所含HCO3-物质的量小于0.1mol,B项错误;C项,CO与H2O(g)生成CO2和H2的反应为可逆反应,反应的化学方程式为CO+H2O(g)
1L=0.1mol,HCO3-在溶液中既存在电离平衡又存在水解平衡,溶液中所含HCO3-物质的量小于0.1mol,B项错误;C项,CO与H2O(g)生成CO2和H2的反应为可逆反应,反应的化学方程式为CO+H2O(g)![]() CO2+H2,0.1molCO与0.1molH2O(g)充分反应生成的H2物质的量小于0.1mol,C项错误;D项,反应中S元素的化合价由-1价升至0价,C元素的化合价由0价升至+2价,Fe元素的化合价部分由+2价升至+3价(Fe3O4可写成FeO·Fe2O3),O元素的化合价全由0价降至-2价,生成6molS,转移32mol电子,每生成0.6molS,转移电子物质的量为3.2mol,D项正确;答案选D。
CO2+H2,0.1molCO与0.1molH2O(g)充分反应生成的H2物质的量小于0.1mol,C项错误;D项,反应中S元素的化合价由-1价升至0价,C元素的化合价由0价升至+2价,Fe元素的化合价部分由+2价升至+3价(Fe3O4可写成FeO·Fe2O3),O元素的化合价全由0价降至-2价,生成6molS,转移32mol电子,每生成0.6molS,转移电子物质的量为3.2mol,D项正确;答案选D。


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述中,正确的是
|
|
|
|
图Ⅰ碱性锌锰电池 | 图Ⅱ铅-硫酸蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ银锌纽扣电池 |
A. 图Ⅰ所示电池中,MnO2的作用是催化剂
B. 图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C. 图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标况下将CO2气体缓缓地通入到含2 mol KOH、1 mol Ba(OH)2和2 mol KAlO2的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示。下列关于整个反应进程中的各种描述正确的是
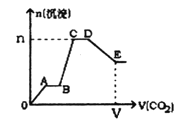
A.A~B段和C~D段发生的反应相同
B.B~C段反应的离子方程式是A1O2-+2H2O+CO2=Al(OH)3↓+HCO3-
C.V=134.4 L,n=3mol
D.D点所得溶液中离子浓度的关系为:c(K+)>c(CO32-)>c(OH﹣)>c(HCO3-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化钛是无色液体,沸点为136℃,极易水解。在800℃下,将氯气通过二氧化钛和炭粉的混合物可制得四氯化钛,同时产生一种有毒气体。装置如下图。
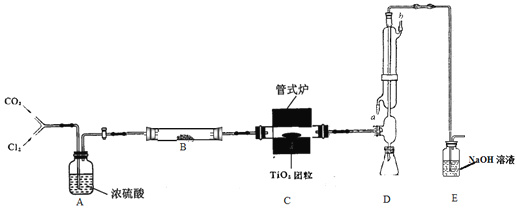
(1)实验步骤:
先将适量TiO2、炭粉混合均匀,制成多孔状TiO2团粒。然后进行如下操作,正确的顺序为____________________(填序号)。
①通入CO2气体并开始加热;
②观察反应已基本完成,停止加热,改通CO2气体直至冷却至室温;
③将TiO2团粒放入瓷管中适当位置,并连接好整套装置;
④当管式炉升温到800℃后改通Cl2,同时在冷凝管中通冷凝水;
⑤取下锥形瓶,立即用塞子塞紧。
实验中不直接使用二氧化钛和炭粉,而是先制成多孔状TiO2团粒的原因是_________。
(2)冷凝管冷凝水的入口为________(填标号)。
(3)装置B所装的药品为_____________,作用为________________;实验中两次通入CO2,其中第二次通入CO2的作用是______________;可用_______气体代替CO2(任填一种)。
(4)以上步骤②,观察到(填现象)________________时,可确定反应已基本完成。
(5)制备反应的主要化学方程式为_________________________________________。
(6)该装置存在明显的缺陷,提出改进措施__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法正确的是

A. O2所在的铂电极处发生氧化反应
B. H+透过质子交换膜流向呼气所在的铂电极
C. 电路中流过2mol电子时,消耗标准状况下11.2LO2
D. 该电池的负极反应式为:CH3CH2OH+3H2O-12e-=2CO2+12H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案中不能达到相应实验目的的是
选项 | A | B | C | D |
方案 |
|
|
|
|
目的 | 探究浓度对化学反应速率的影响 | 探究催化剂对H2O2分解速率的影响 | 室温下比较NaHCO3和Na2CO3的溶解度 | 探究温度对化学平衡的影响 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:HCl + NH3= NH4Cl(固体)如下图所示,抽去装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度。下列说法正确的是( )
![]()
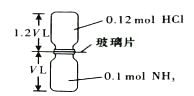
A. 反应后瓶内压强是反应前的1/10 B. 装置中氢元素的总质量为0.42 g
C. 生成物的分子数目为0.1 NA D. 反应结束后,两个集气瓶很容易分开
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的A、B两种酸溶液各lmL,分别加水稀释到1000 mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法正确的是( )
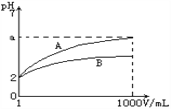
A. A、B两种酸溶液物质的量浓度一定相等
B. 稀释后A酸溶液的酸性比B酸溶液强
C. a=5时,A是强酸,B是弱酸
D. 若A、B都是弱酸,则5≥a>2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中的两种物质不论以何种比例混合,只要混合物的总物质的量一定,则完全燃烧消耗O2的质量保持不变的是( )
A. C2H4、C2H6O B. C2H6、C2H6O C. C3H6、C2H4 D. C3H4、C2H6O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com