
| ||
| ||
| 168×(a-b)g |
| 62 |
| 84(a-b) |
| 31 |
| 84(a-b) |
| 31 |
| 84b-53a |
| 31 |
| 106×(a-b) |
| 62 |
| 53(a-b) |
| 31 |
| 53(a-b) |
| 31 |
| 53a |
| 84 |
| 84b-53a |
| 31 |
| 53(a-b) |
| 31 |
| 53a |
| 84 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A、CH3COOH的球棍模型 |
B、第三周期简单阴离子结构示意图均可表示为 |
| C、HIO结构式为H-I-O |
| D、37Cl中的37代表该原子的相对原子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学查资料得知α-AgI是一种固体导体,导电率很高.他为了研究α-AgI究竟是Ag+离子导电还是I-离子导电,设计一个如图所示(用铅蓄电池做电源)的电化学实验.
某同学查资料得知α-AgI是一种固体导体,导电率很高.他为了研究α-AgI究竟是Ag+离子导电还是I-离子导电,设计一个如图所示(用铅蓄电池做电源)的电化学实验.| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
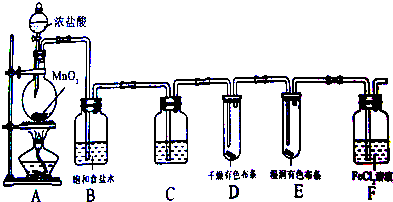
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知Ra是第七周期、ⅡA族的元素,故Ra(OH)2的碱性比Mg(OH)2的碱性强 |
| B、已知As是第四周期、ⅤA族的元素,故AsH3的稳定性比NH3的稳定性强 |
| C、已知Cs的原子半径比Na的原子半径大,故Cs与水反应比Na与水反应更剧烈 |
| D、已知Cl的核电荷数比Al的核电荷数大,故Cl的原子半径比Al的原子半径小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com