
已知:在100℃时,纯水的c(H+)为1×10—6,此时将pH=12的NaOH溶液V1 L与pH=l的H2SO4溶液V2 L混合,若所得混合溶液的pH=10,则V1∶V2为:
A.1∶9 B.10∶1 C.9∶1 D.1∶10
科目:高中化学 来源: 题型:
T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表:
元素 | 相关信息 |
T | T元素可形成自然界硬度最大的单质 |
W | W与T同周期,核外有三个未成对电子 |
X | X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1817kJ/mol, I3=2745kJ/molkJ/mol,I4=11575kJ/mol |
Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
Z | Z的一种同位素的质量数为63,中子数为34 |
(1)Y在周期表中的位置 ,Y、氧、W元素的第一电离能由大到小顺序为 (用元素符号作答)。
(2)TY2是一种常用的溶剂,是 (填极性分子或非极性分子),分子中存在 个σ键。
(3)写出X与NaOH溶液反应的离子方程式 。超高导热绝缘耐高温纳米XW在绝缘材料中应用广泛,晶体与金刚石类似,属于 晶体.W的最简单氢化物容易液化,理由是 。
(4)Z的基态原子核外电子排布式为 。元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z+HCl+O2=ZCl+HO2,HO2 (超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示错误的是
A.氧化剂是O2 B.HO2在碱中不能稳定存在
C.氧化产物是HO2 D.1 molZ参加反应有1 mol电子发生转移
(5)已知Z的晶胞结构如下图所示,又知Z的密度为9.00 g·cm-3,则晶胞边长为 ;ZYO4常作电镀液,其中YO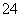 的空间构型是 ,其中Y原子的杂化轨道类型是 。
的空间构型是 ,其中Y原子的杂化轨道类型是 。

查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.Fe在一定条件下与水反应生成H2和Fe(OH)3
B.Fe3O4溶于盐酸后加入几滴KSCN溶液,溶液显血红色
C.FeCl2溶液蒸干灼烧后得到FeCl2固体
D.将FeCl3饱和溶液滴入NaOH溶液中可制备Fe(OH)3胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
用0.1mol·L—1的盐酸滴定0.1mol·L—1的氨水,在滴定过程中不可能出现的结果是:
A.c(NH4+)>c(Cl-),c(OH-)>c(H+)
B.c(NH4+)=c(Cl-),c(OH-)=c(H+)
C.c(Cl-)>c(NH4+),c(OH-)>c(H+)
D.c(Cl-)>c(NH4+),c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
向体积为 Va 的0.05mol·L-1CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,下列关系错误的是:
A.Va>Vb时:c (CH3COOH) +c (CH3COO-)>c (K+)
B.Va=Vb时:c (CH3COOH) +c (H+)=c (OH-)
C.Va<Vb时:c (CH3COO-)>c (K+)> c (OH-)> c (H+)
D.Va与Vb任意比时:c (K+)+ c (H+) =c (OH-)+ c (CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中有关物质的量浓度关系和计算不正确的是:
A.c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2] < c[(NH4)2SO4] < c(NH4Cl)
B.已知25°C时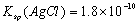 ,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到
,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到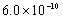 mol·L-1
mol·L-1
C.0.2mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH=1
D.室温下,0.1mol·L-1NaHA溶液的pH=4,则有C(HA-) >C(H+)>C(A2-)>C(H2A)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语表示正确的是[微软用户2]
A.四氯化碳分子球棍模型: 
B.二氧化硅的分子式:SiO2
C. S2-离子结构示意图
D.聚丙烯的结构简式: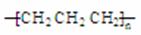
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠(Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等。实验室可通过Na2S、Na2CO3和SO2共同反应来制取Na2S2O3。[微软用户19]
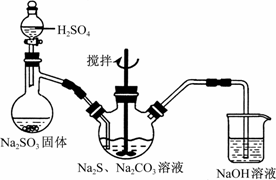

图1 图2
(1)写出图1所示装置中三颈瓶中由反应制取Na2S2O3的化学方程式_ ▲ ___。
如将分液漏斗中的H2SO4改成浓盐酸,则三颈烧瓶内除Na2S2O3生成外,还有__▲___(填化学式)杂质生成。
(2)为测定所得保险粉样品中Na2S2O3·5H2O的质量分数,可用标准碘溶液进行滴定,反应方程式为2Na2S2O3+I2===2NaI+Na2S4O6。
① 利用KIO3、KI和HCl可配制标准碘溶液。写出配制时所发生反应的离子方程式:________▲___________。
② 准确称取一定质量的Na2S2O3·5H2O样品于锥形瓶中,加水溶解,并滴加__▲ 作指示剂,用所配制的标准碘溶液滴定。滴定时所用的玻璃仪器除锥形瓶外,还有__▲___。
③ 若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果___▲___(填“偏高”“偏低”或“不变”)。
(3)本实验对Na2S的纯度要求较高,利用图2所示的装置可将工业级的Na2S提纯。已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。提纯步骤依次为:
① 将已称量好的工业Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
② 按图2所示装配所需仪器,向冷凝管中通入冷却水,▲ 进 ▲出(用字母“a”、“b”填空)水浴加热;高 考 资 源 网
③ 待__▲___时,停止加热,将烧瓶取下;
④ ________________▲___________;
⑤ ______________▲__________;
⑥ 将所得固体洗涤、干燥,得到Na2S·9H2O晶体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com