
| A、前10min反应的平均速率V(C)=0.10mol/L?min |
| B、10min后向容器中加入A,重新平衡时A的转化率一定大于50% |
| C、恒温下将反应容器体积缩小一半,则D的平衡浓度小于1.0mol/L |
| D、反应达平衡时B的平衡浓度是1.5mol/L |
| △c |
| △t |
| n |
| V |
| △c |
| △t |
| ||
| 10min |
| 2mol |
| 4mol |
| 1mol |
| 1L |
| n |
| V |
| 3mol |
| 2L |


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、室温下将CaO、Na2O、Na、NaOH各5克分别投入100克水中,充分搅拌后,所得溶液中溶质的质量分数最小的是CaO |
| B、正戊烷、异戊烷、新戊烷的熔沸点由高到低的顺序为新>异>正 |
| C、AlO2-、HCO3-、Na+、K+等离子不能在水溶液里大量共存 |
| D、将NaHCO3溶液和Na2SO3溶液分别蒸干灼烧,得到的固体都不是原溶质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
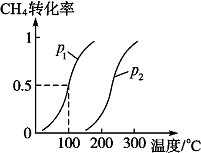 将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应Ⅱ:CH4(g)+H2O(g)?CO(g)+3H2(g),CH4的转化率与温度、压强的关系如图.
将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应Ⅱ:CH4(g)+H2O(g)?CO(g)+3H2(g),CH4的转化率与温度、压强的关系如图.查看答案和解析>>
科目:高中化学 来源: 题型:
A、Cu
| |||||
B、Cu
| |||||
C、Cu
| |||||
D、Cu
|
查看答案和解析>>
科目:高中化学 来源: 题型:
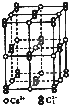 碳族元素的单质及其化合物是一类重要物质.请回答下列问题:
碳族元素的单质及其化合物是一类重要物质.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com