
(10��)��֪��pHΪ4��5�Ļ����У�![]() ������ˮ�⣬��
������ˮ�⣬��![]() ����ȫˮ�⣬ת��Ϊ
����ȫˮ�⣬ת��Ϊ![]() ��ijͬѧ���ᴿ��������
��ijͬѧ���ᴿ��������![]() ����ϡ�����
����ϡ�����![]() ��Һ�������õ�ⴿ����
��Һ�������õ�ⴿ����![]() ��Һ�õ������ݣ�����
��Һ�õ������ݣ�����![]() �����ԭ��������
�����ԭ��������
(1)��������![]() ��ϡ�����
��ϡ�����![]() ��Һ�У������Թ����ĺ�ɫ��ĩA���衢���ˣ��õ��ϴ�����
��Һ�У������Թ����ĺ�ɫ��ĩA���衢���ˣ��õ��ϴ�����![]() ��Һ��
��Һ��
 A�Ļ�ѧʽΪ________________������A��������______________
A�Ļ�ѧʽΪ________________������A��������______________
________________________________________________________��
(2)���ϴ�����![]() ��Һ������ͼ��ʾ��װ���н��е�⣬ʯī��
��Һ������ͼ��ʾ��װ���н��е�⣬ʯī��
���ϵĵ缫��ӦʽΪ______________________________________��
��ⷴӦ�����ӷ���ʽΪ__________________________________��
(3)ʵ����ɺ�ʯī�缫������״���µ�����V mL��ͭ�缫����![]()
![]() ����Cu����
����Cu����
��ԭ������(�ô���a��V�ļ���ʽ��ʾ)Ϊ________________________��
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| 17 |
| 2 |
| 17 |
| 2 |
| c(CO2)2 |
| c(CO)2��c(O2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012��ɽ��ʡ����һ�и�����ѧ����ĩ��⻯ѧ�Ծ� ���ͣ������
(10��)�������������������ܽ�Ȳ�ͬ����˿���������һ���ʣ�������Һ��pH���ﵽ����������ӵ�Ŀ�ġ����ܽ��������������ڲ�ͬpH�µ��ܽ��(s��mol��L��1)����ͼ��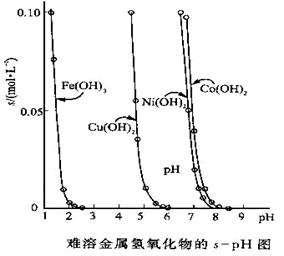
(1)pH��3ʱ��Һ��ͭԪ�ص���Ҫ������ʽ�ǣ�________(��ѧʽ)
(2)��Ҫ��ȥCuCl2��Һ�е�����Fe3����Ӧ�ÿ�����Һ��pHΪ
A����1 B��4���� C����6
(3)��Ni(NO3)2��Һ�к���������Co2�����ʣ�___ (�ܡ�����)ͨ��������ҺpH�ķ�������ȥ��������_________��
(4)��֪һЩ��������ܶȻ��������±���
| ���� | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3��10��18 | 2.5��10��13 | 1.3��10��36 | 3.4��10��28 | 6.4��10��53 | 1.6��10��24 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ��ɽ����������һ�и���12���¿���ѧ�Ծ� ���ͣ������
(16��)Fenton�������ڴ������ѽ����л���Ĺ�ҵ��ˮ��ͨ�����ڵ��ں�pH��Fe2+Ũ�ȵķ�ˮ�м���H2O2�����������ǻ����ɻ�������������Ⱦ������ø÷��������л���Ⱦ��p-CP����̽���й����ضԸý��ⷴӦ���ʵ�Ӱ�졣ʵ���п���p-CP�ij�ʼŨ����ͬ���㶨ʵ���¶���298K��313K������ʵ���������±���������¶Ա�ʵ�顣
��1�����������ʵ����Ʊ�����������Ŵ�Ӧ�����ݣ���
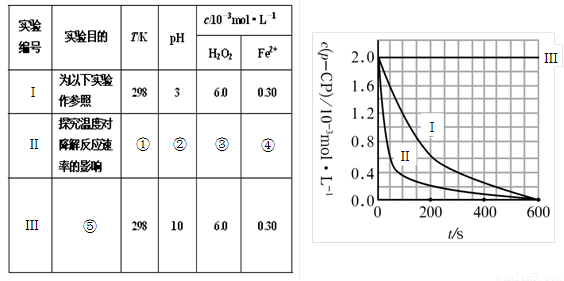
�� �� �� ��
��
��2��ʵ����p-CP��Ũ����ʱ��仯�Ĺ�ϵ������ͼ��ʾ��
a�����������ͼʵ������ߣ����㽵�ⷴӦ��50��300s�ڵ�ƽ����Ӧ����v��p-CP��= ���Լ�300sʱp-CP�Ľ�����Ϊ ��
b��ʵ�������¶����ߣ����ⷴӦ���� �����������С�����䡱����
c��ʵ���ó��Ľ����ǣ�pH=10ʱ�� ��
��3����ͨ����ӦFe3+
+ SCN��  Fe��SCN��2+ �����鷴Ӧ�Ƿ���������ӡ���֪��һ���¶��¸÷�Ӧ�ﵽƽ��ʱc��Fe3+��=0.04 mol/L��c��SCN����=0.1mol/L��c[Fe��SCN��2+]=0.68mol/L������¶��¸÷�Ӧ��ƽ�ⳣ��K= ��
Fe��SCN��2+ �����鷴Ӧ�Ƿ���������ӡ���֪��һ���¶��¸÷�Ӧ�ﵽƽ��ʱc��Fe3+��=0.04 mol/L��c��SCN����=0.1mol/L��c[Fe��SCN��2+]=0.68mol/L������¶��¸÷�Ӧ��ƽ�ⳣ��K= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�����ʡ�����и߶���һѧ�ڵڶ����¿���ѧ�Ծ� ���ͣ������
(14��)��֪�� 25��ʱ��pH��Ϊ5��H2SO4��Һ��NH4Cl��Һ���ش��������⣺
(1)����Һ��c(H��)��c(OH��)��________��
(2)��ȡ5 mL������Һ���ֱ��ˮϡ����50 mL��pH�ϴ����________��Һ��
(3)��ȡ5 mL������Һ���ֱ���ȵ�90�棬pH��С����________��Һ��
(4)����Һ����ˮ�������c(H��)�ֱ�Ϊ��H2SO4��Һ________��NH4Cl��Һ________��
(5)ȡ5 mL NH4Cl��Һ����ˮϡ����50 mL��c(H��)________10��6 mol��L��1(�����������������)��c(NH)/c(H��)________(���������С�����䡱)��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com