
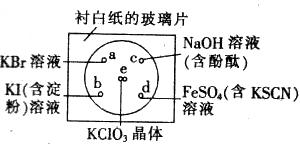
ijͬѧ�����в�������ʵ�飺��һ���³İ�ֽ�IJ���Ƭ�IJ�ͬλ�÷ֱ�μ�Ũ�Ⱦ�Ϊ0.1mol/L��KBr��KI�������ۣ���NaOH������̪����FeSO4����KSCN����Һ��һ�Σ�ÿ��Һ�α˴˷ֿ���Χ�ɰ뾶С�ڱ������Բ�Σ���ͼ������Բ�Ĵ�����2��֥���С��KClO3���壬��KClO3����μ�һ��Ũ���ᣬ��ClO3��+5Cl��+6H+=3Cl2��+3H2O����������������Ǻã��йط�Ӧ��������Ӧ��������ԭ��Ӧ�����ӷ���ʽ����ȷ����( )

A.a����Һ�Ի�ɫ��2Br��+Cl2=2Cl��+Br2
B.b����Һ����ɫ��2I��+Cl2=2Cl��+I2
C.c����Һ�ĺ�ɫ��ȥ��2OH��+Cl2=Cl��+ClO��+H2O
D.d����Һ�Ժ�ɫ��Fe2++Cl2=Fe3++2Cl��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʵ�鲽�� | �й����� | �ټ�������KCl������ | ��Ҫ����KCl������Ϊ 7.5 7.5 �� |
�ڳ���KCl���� | ������Ҫ�õ�����Ҫ�����ǣ� ������ƽ ������ƽ |
�۽�KCl����100mL�ձ��У�����������ˮ | Ϊ�˼ӿ��ܽ����ʣ����Բ�ȡ��Щ��ʩ�� �ò��������� �ò��������� |
�ܽ��ձ�����Һת����500mL����ƿ�� | Ϊ�˷�ֹ��Һ������Ӧ��ȡʲô��ʩ�� �ò������������� �ò������������� |
��������ƿ�м�����ˮ���̶��� | �ڽ��д˲���ʱ����ˮ���̶���1-2���״�Ӧ��β����� ���ý�ͷ�ιܼ�ˮ����Һ����̶������� ���ý�ͷ�ιܼ�ˮ����Һ����̶������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʵ�鲽�� | �й����� |
| ��1����������KCl������ | ��ҪKCl������Ϊ 7.5 7.5 g |
| ��2������KCl���� | ������������Ҫ�õ��������� ������ƽ��ҩ�� ������ƽ��ҩ�� |
| ��3����KCl���뵽100mL�ձ��м�ˮ�ܽ� | Ϊ�ӿ��ܽ��ٶȣ��ɲ�ȡ�Ĵ�ʩ�� ���衢���ȡ���ϸ�Ȼ��Ƶȴ�ʩ ���衢���ȡ���ϸ�Ȼ��Ƶȴ�ʩ |
| ��4�����ձ��е���Һת����500mL����ƿ�� | Ϊ��ֹ��Һ������Ӧ��ȡ�Ĵ�ʩ�� ���������� ���������� |
| ��5��������ƿ�м�����ˮ���̶��� | �ڽ��д˲���ʱӦע��������� ��ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμ�����Һ��Һ����̶���ˮƽ���У� ��ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμ�����Һ��Һ����̶���ˮƽ���У� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

ָ������Ӧװ���õ��ĺ�������(����)
a.Բ����ƿ b.����ƿ c.�ζ��� d.�ƾ��� e.��ͨ©�� f.�ձ� g.��Ͳ h.����©�� i.��Һ©�� j.����̨ k.ˮ�� l. ?��ƿ
I��____________����____________����____________��
(1)��װ�����巢��װ�ú���ȷ˳��д���Ʊ��Ȼ������Ҫ�������裺________________��
(2)д���ڢ��ܷ����ķ�Ӧ�Ļ�ѧ����ʽ________________________��
(3)ָ���ڢ�͢ɹ۲쵽������
��____________________________________��
��____________________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com