
| A. | 石英坩埚耐高温,可用来加热熔融氢氧化钠固体 | |
| B. | 聚氯乙烯塑料在日常生活中可用来进行食品包装 | |
| C. | 硫酸亚铁溶液和水玻璃在空气中久置后均变质 | |
| D. | 甲醛可用作食品防腐剂 |
分析 A.石英的成分是二氧化硅;
B.聚氯乙烯易分解放出有害物质;
C.硫酸亚铁具有强的还原性,能够被氧气氧化,水玻璃主要成分硅酸钠水溶液,能够吸收空气中二氧化碳,反应生成碳酸钠和硅酸;
D.甲醛有毒.
解答 解:A.石英的成分是二氧化硅,在加热条件下与NaOH反应而使坩埚炸裂,故A错误;
B.聚氯乙烯易分解放出有害物质,不能用来进行食品包装,故B错误;
C.硫酸亚铁具有强的还原性,能够被氧气氧化,水玻璃主要成分硅酸钠水溶液,能够吸收空气中二氧化碳,反应生成碳酸钠和硅酸,久置后均变质,故C正确;
D.甲醛有毒,能破坏蛋白质的结构,使之失去生理功能,故D错误.
故选C.
点评 本题考查了元素化合物知识、材料以及食品添加剂等知识,题目难度不大,熟悉变质的原理是解题关键,为易错点.


 互动课堂系列答案
互动课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯化氢的摩尔质量等于NA个氯分子和NA个氢分子的质量之和 | |
| B. | 在1 mol NaHSO4晶体中,含阳离子数为2NA | |
| C. | 121 g CCl2F2所含的原子个数为5NA | |
| D. | 62 g Na2O溶于水后所得溶液中含有02-离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HNO3在反应中既表现氧化性也表现出酸性 | |
| B. | 每生成22.4 L NO(标准状况)有3 mol电子转移 | |
| C. | HNO3作氧化剂,铜作还原剂,3 mol Cu还原8 mol的HNO3 | |
| D. | HNO3作氧化剂,铜作还原剂,3 mol Cu还原2 mol的HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 成分 | NaOH | Na2CO3 | H2O |
| 质量分数 | 90.4% | 3.8% | 5.8% |
| A. | 2.34 g | B. | 4.68 g | C. | 5.85 g | D. | (2.34-a) g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属材料都是导体,非金属材料都是绝缘体 | |
| B. | 氢氧化铝可作胃酸的中和剂 | |
| C. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 | |
| D. | SO2溶于水能导电,SO2属于电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
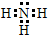 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

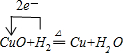
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
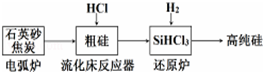
| 发生的主要反应 | |
| 电弧炉 | SiO2+2C$\frac{\underline{\;1600-1800℃\;}}{\;}$si+2CO |
| 流化床反应器 | Si+3HCl$\frac{\underline{\;250-300\;}}{\;}$SiHCl3+H2 |
| 还原炉 |
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/°C | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com