
【题目】将0.65g锌加到50.0mL浓度为1.00mol·L-1的盐酸溶液中,试计算:(写出计算过程)
(1)在标准状况下,可生成氢气的体积_________?
(2)若反应完成后,溶液体积仍为50.0mL,这时溶液中的锌离子浓度和氢离子浓度各为多少?c(Zn2+)_________、c(H+)___________。
【答案】0.224L 0.2mol/L 0.6mol/L
【解析】
(1)锌和盐酸反应生成氯化锌和氢气,依据化学方程式定量关系计算得到;
(2)依据化学方程式计算生成的锌离子物质的量,剩余氢离子物质的量,c=![]() 计算浓度。
计算浓度。
(1)0.65g锌的物质的量n(Zn)=0.65g÷65g/mol=0.01mol,50mL 1mol/L的盐酸中溶质物质的量n(HCl)=0.050L×1mol/L=0.05mol;锌和盐酸反应生成氯化锌和氢气,反应方程式为:Zn+2HCl=ZnCl2+H2↑,根据反应方程式中物质消耗关系可知氯化氢过量,依据反应的锌物质的量计算生成氢气物质的量为0.01mol,其标准状况下气体体积V(H2)=0.01mol×22.4L/mol=0.224L;
(2)由化学方程式可知生成的锌离子物质的量为0.01mol,剩余氢离子物质的量=0.05mol-0.02mol=0.03mol,若反应结束后,溶液的体积仍为50mL依据c=![]() 计算浓度,c(Zn2+)=0.01mol÷0.05L=0.2mol/L,c(H+)=0.03mol÷0.05L=0.6mol/L。
计算浓度,c(Zn2+)=0.01mol÷0.05L=0.2mol/L,c(H+)=0.03mol÷0.05L=0.6mol/L。


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NOx,会污染大气。采用NaClO、Ca(C1O)2溶液作为吸收剂可同时对烟气进行税硫、脱硝,下列说法正确的是
①SO2(g)+2OH-(aq)![]() SO32-(aq)+H2O(l) ΔH1=a KJ/mol
SO32-(aq)+H2O(l) ΔH1=a KJ/mol
②ClO-(aq)+SO32-(aq)![]() SO42-(aq)+Cl-(aq) ΔH2=b KJ/mol
SO42-(aq)+Cl-(aq) ΔH2=b KJ/mol
③CaSO4(s)![]() Ca2+(aq)+ SO42- (aq) ΔH3=c KJ/mol
Ca2+(aq)+ SO42- (aq) ΔH3=c KJ/mol
④SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)![]() CaSO4(s)+H2O(l)+Cl-(aq)ΔH4=dKJ/mol
CaSO4(s)+H2O(l)+Cl-(aq)ΔH4=dKJ/mol
A. 随着吸收反应的进行,吸收剂溶液的pH逐渐减小
B. 反应①、②均为氧化还原反应
C. 反应Ca(OH)2(aq)+H2SO4(aq)=CaSO4(s)+2H2O(1)的ΔH=-ckJ/mol
D. d=a+b+c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性ZnO在橡胶、塑料等工业中有重要应用,某工厂以含铅锌烟气(主要成分是ZnO、PbO,还有少量FeO、CuO)制备活性ZnO的工艺流程如下:

(1)下图为温度与Zn、Pb元素浸出率的关系图,“酸浸”时采用30℃而不是更高的温度的原因是:①减少盐酸挥发;②____。

(2)“氧化”的目的是除去酸浸液中的Fe2+,在pH约为5.1的溶液中,加入高锰酸钾溶液,生成MnO2和Fe(OH)3沉淀,该反应的离子方程式为____。
(3)①若“过滤I”所得的滤液浑浊,则处理的方法为____。
②“除杂”时,滤渣Ⅱ的主要成分是Cu、Pb,试剂X应为____。
(4)在“过滤Ⅱ”后的溶液中加入Na2CO3溶液,生成碱式碳酸锌[Zn2(OH)2CO3]等物质。
①该反应的化学方程式为____。
②检验碱式碳酸锌洗涤干净的操作为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiCl3是烯烃定向聚合的催化剂、TiCl4可用于制备金属Ti。
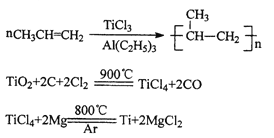
(1)Ti3+的基态核外电子排布式为__________
(2)丙烯分子中,碳原子轨道杂化类型为__________
(3)Mg、Al、Cl第一电离能由大到小的顺序是___________
(4)写出一种由第2周期元素组成的且与CO互为等电子体的阴离子的电子式________
(5)TiCl3浓溶液中加入无水乙醚,并通入HCl至饱和,在乙醚层得到绿色的异构体,结构式分别是[Ti(H2O)6]Cl3、[Ti(H2O)5Cl]Cl2·H2O。1mol[Ti(H2O)6]Cl3中含有σ键的数目为______.
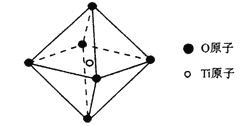
(6)钛酸锶具有超导性、热敏性及光敏性等优点,该晶体的晶胞中Sr位于晶胞的顶点,O位于晶胞的面心,Ti原子填充在O原子构成的正八面体空隙的中心位置,据此推测,钛酸锶的化学式为_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴元素由于其良好的物理化学性质,被广泛应用于生产生活中。从含钴废料(含CoO、Co2O3、单质Al、Li等)中制取粗CoCl2·6H2O的流程如下所示。
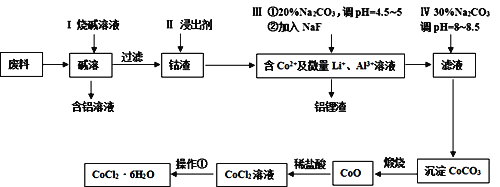
请回答下列问题:
(1)步骤I中主要发生的化学反应方程式为______。
(2)已知Co2O3具有强氧化性,若步骤II中浸出剂为盐酸,造成的后果是_______。
(3)步骤Ⅲ中①的目的是除去Al3+,写出该步反应的离子方程式______。
(4)若在实验室煅烧CoCO3,所需的硅酸盐质仪器除酒精灯和玻璃棒外,还有______、______(填仪器名称)。
(5)操作①是在HCl氛围中进行的,其步骤是______、_____、过滤、洗涤、干燥。洗涤过程中可以用工业酒精代替水,其优点是_____。
(6)某同学用标准硝酸银溶液滴定未知浓度的CoCl2溶液,下列可作为指示剂的是____(填选项,忽略亚钴离子的颜色干扰)
A.KCl B.KSCN C.K2CrO4 D.K2S
已知几种物质在20℃时的颜色及Ksp值如下表
化学式 | AgCl | AgSCN | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 黑色 | 红色 |
Ksp | 2.0×10-10 | 1.0×10-12 | 2.0×10-48 | 2.0×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:A(g)+3B(g)![]() 2C(g),有关下列图像说法的不正确的是( )
2C(g),有关下列图像说法的不正确的是( )
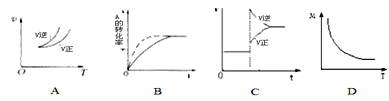
A. 依据图A可判断正反应为放热反应
B. 在图B中,虚线可表示使用了催化剂
C. 若正反应的△H<0,图C可表示升高温度使平衡向逆反应方向移动
D. 由图D中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年3月,黄浦江上游水质污染较为严重,相关自来水厂采用多种方法并用的方式进行水质处理,下列说法中错误的是( )
A. 加活性炭可吸附水中小颗粒,净化水质的方法属于物理方法
B. 加臭氧对水进行消毒,利用了臭氧的氧化性
C. 用细菌与酶的扩充法去除水中的氨氮的方法属于生物法
D. 用聚合硫酸铁作为净水剂,该处理过程中仅发生了化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有Al、Cl2、Al2O3、HCl(aq)、A1(OH)3、NaOH(aq)六种物质,它们之间有如图所示转化关系,图中每条线两端的物质之间都可以发生反应,下列推断中不合理的是( )
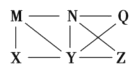
A. N一定是HCl(aq)B. X可能是Al或Cl2
C. Q、Z中的一种必定为A12O3D. Y一定为NaOH(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的理解正确的是
A. 2-丁醇的结构简式:![]()
B. 电子式 ![]() : 可以表示羟基,也可以表示氢氧根离子
: 可以表示羟基,也可以表示氢氧根离子
C. 比例模型 ![]() :可以表示甲烷分子,也可以表示四氯化碳分子
:可以表示甲烷分子,也可以表示四氯化碳分子
D. 聚丙烯的结构简式: ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com