
以淀粉为原料可以发生以下转化, 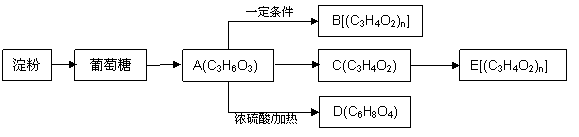
已知:
① A能与NaHCO3溶液放出CO2,1mol的A能和足量的Na反应生成1mol H2。
② 聚合物B和聚合物E不是同种物质
③ C能使溴的四氯化碳溶液褪色
④ D分子中含有六元环
回答以下问题:
(1)写出淀粉生成葡萄糖的化学方程式 。
(2)有机物C中官能团的名称为 。
(3)写出D的结构简式 。
(4)写出生成B的化学方程式 。
科目:高中化学 来源: 题型:
以下物质间的每步转化通过一步反应就能实现的是( )
A.Al--Al2O3--Al(OH)3--NaAlO2 B.Mg--MgCl2--Mg(OH)2—MgO
C.S--SO3-- H2SO4-- MgSO4 D.Si--SiO2--H2SiO3--Na2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、D、X、Y、Z为原子序数依次增大的六种元素,其中A、B、D、X、Y为短周期元素,Z为第四周期元素,Z还是前四周期中电负性最小的元素。
已知:A原子的核外电子数与电子层数相等;
B元素原子的核外p电子数比s电子数少1个;
D原子的第一至第四电离能为I1=738 kJ/mol,I2=1451 kJ/mol,I3=7733 kJ/mol,I4=10540 kJ/mol;
X原子核外所有p轨道为全充满或半充满;
Y元素的族序数与周期序数的差为3;
(1) Z代表的元素对应的离子的核外电子排布式:________________。
(2)某同学根据题目信息和掌握的知识分析X的核外电子排布为

该同学所画的轨道式违背了 原理。
(3)已知BA5为离子化合物,写出其电子式:______________。
(4) 元素X与元素Y相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________。
a.常温下X的单质和Y的单质状态不同 b.Y的氢化物比X的氢化物稳定
c.一定条件下Y的单质能与氢氧化钠溶液反应,而X的单质不容易反应。
d.Y的最高价氧化物对应的水化物的酸性比X的最高价氧化物对应的水化物酸性强。
(5)元素X和元素Y的第一电离能的大小关系为 (填元素符号),理由为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在0.lmol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH  CH3COO-+H+ 对于该平衡,下列叙述正确的是
CH3COO-+H+ 对于该平衡,下列叙述正确的是
A.加入少量CH3COONa固体,平衡向逆向移动,溶液导电能力增强
B.加入少量NaOH固体,平衡向正向移动,溶液中c(H+)增大
C.加水,平衡向正向移动, c(CH3COOH)/ c(CH3COO-)增大
D.通入少量 HCl气体,平衡逆向移动,溶液中c(H+)减少
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物的结构简式为 ,下列关于该有机物的叙述不正确的是
,下列关于该有机物的叙述不正确的是
A.能与金属钠发生反应并放出氢气
B.能在催化剂作用下与氢气发生加成反应
C.在铜的催化作用下,能被氧化成羧酸类物质
D.在浓硫酸催化下,能与乙酸发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作或实验所得出的结论一定正确的是 ( )
A.加热NH4 Cl晶体时,用湿润的红色石蕊试纸靠近试管口,检验NH3的生成
B.制备Fe(OH)2胶体时,应往沸水中逐滴加1mol·L-1的FeCl3溶液,并继续加热到液体呈透明的红褐色为止
C.将金属钠在研钵中研成粉末,使钠与水反应的实验更安全
D.用托盘天平准确称取5. 85克NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
合金与纯金属制成的金属材料相比,优点是( )
①合金的硬度一般比它的各成分金属的大;
②一般地,合金的熔点比它的各成分金属的低;
③改变原料的配比、改变生成合金的条件,可以得到具有不同性能的合金;
④合金比纯金属的导电性能更强;
⑤合金比纯金属的应用范围更广泛。
A.①②③⑤ B.②③④
C.①②④ D.①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
A和B均为短周期元素,它们的离子A-和B2+具有相同的核外电子层结构。下面说法正确的是
A.原子序数A > B B.核外电子数A > B
C. 原子半径A > B D.离子半径 A- > B2+
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两池的电极材料如图所示,请按要求回答下列问题:
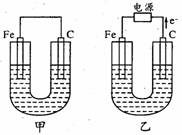
(1)若两池中均为Cu(NO3)2溶液,反应一段时间后:
①有红色物质析出的是甲池中的 (填“铁”或“碳”)棒;乙池中的 (填“阴”或“阳”)极。
②乙池中阳极上发生的电极反应方程式是 。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的化学方程式: 。
②甲池中碳极上电极反应方程式是 ,乙池碳极上
电极反应属于 (填“氧化反应”或“还原反应”)。
③将湿润的淀粉KI试纸放在乙池碳极附近,发现试纸变蓝,待一段时间后又发现
蓝色褪去。这是因为过量的Cl2将生成的I2又氧化。若反应的C12和I2物质的量
之比为5:1,且生成HCl和另一种强酸,该强酸的化学式为 。
④若乙池中转移0.1 mol e-后停止实验,池中溶液体积是1L,则溶液混匀后的pH= (不考虑所生成的气体溶解在溶液中的情况)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com