
 I.水的电离平衡曲线如图所示,根据图中数据,回答下列问题:
I.水的电离平衡曲线如图所示,根据图中数据,回答下列问题:| [OH-] |
| [NH3?H2O] |
| c(OH-) |
| c(NH3?H2O) |
| c(OH-) |
| c(NH3?H2O) |


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、装置①中,盐桥中的K+移向ZnSO4溶液 |
| B、滴有酚酞溶液的装置②在电解过程中,b极先变红 |
| C、可以用装置③在铁上镀铜,d极为铜 |
| D、装置④中发生铁的吸氧腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
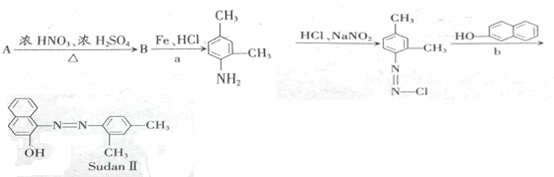
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将氯化铵溶液蒸干制备氯化铵固体 |
| B、从碘水中提取碘单质,用无水乙醇代替四氯化碳 |
| C、加入适量的铜粉除去硝酸铜溶液中的硝酸银杂质 |
| D、用适量盐酸除去硫酸钠溶液中的碳酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、雾霾天气对人的健康造成危害,“雾”和“霾”的分散质微粒不相同 |
| B、氢氧化铁溶胶、蔗糖溶液、淀粉溶液均具有丁达尔效应 |
| C、“地沟油”经过加工处理后,可以用来制肥皂和生物柴油 |
| D、只要符合限量,“食用色素”、“亚硝酸盐”可以作为某些食品的添加剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com