
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)=c(HS-)+2c(S2-)+c(OH-) | |
| B. | c(H2S)+c(HS-)+c(S2-)=0.1 mol/L | |
| C. | 将上述溶液稀释至0.01 mol/L,c(H+)•c(OH-)不变 | |
| D. | c(S2-)+c(OH-)=c(H+)+c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
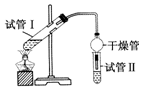 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL 18mol•L-1浓H2SO4 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol•L-1 H2SO4 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的离子积仅适用于纯水 | |
| B. | 水的电离需要直流电 | |
| C. | 升高温度水的离子积增大 | |
| D. | 加入电解质一定会破坏水的电离平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 均为Al(OH)3 | B. | 前者为Al2O3,后者为NaAlO2 | ||
| C. | 均为Al2O3 | D. | 前者为AlCl3,后者为NaAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学事实 | 类推结论 | |
| A | 卤素单质的沸点:F2<Cl2<Br2<I2 | 氢化物沸点:HF<HCl<HBr<HI |
| B | 用电解熔融MgCl2可制得金属镁 | 用电解熔融NaCl也可以制取金属钠 |
| C | 将CO2通入Ba(NO3)2溶液中无沉淀生成 | 将SO2通入Ba(NO3)2溶液中也无沉淀生成 |
| D | Al与S加热时直接化合生成Al2S3 | Fe与S加热时也能直接化合生成 Fe2S3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价化合物中一定不含离子键 | |
| B. | 离子化合物中一定不含共价键 | |
| C. | 金属越活泼金属键越强 | |
| D. | 双原子分子中共价键越强,沸点越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
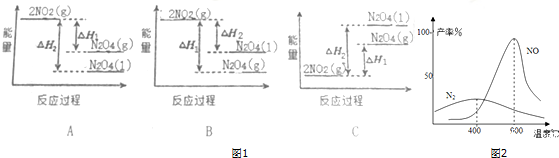
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com