
| A. | N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-1 068 kJ/mol | |
| B. | 肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4+H2O═N2H5++OH- | |
| C. | 铂做电极,以KOH溶液为电解质溶液的肼--空气燃料电池,放电时的负极反应式:N2H4-4e-+4OH-=N2+4H2O | |
| D. | 铂做电极,以KOH溶液为电解质溶液的肼--空气燃料电池,工作一段时间后,KOH溶液的pH将增大 |
分析 A、根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数,进行相应的加减;
B、肼是与氨类似的弱碱,N2H4不是电解质,N2H4•H2O是弱电解质,N2H4•H2O存在电离平衡电离出N2H5+、OH-;
C、原电池总反应为N2H4+O2=N2+2H2O,原电池正极发生还原反应,氧气在正极放电,碱性条件下,正极电极反应式为O2+2H2O+4e-=4OH-,总反应式减去正极反应式可得负极电极反应式;
D、原电池总反应为N2H4+O2=N2+2H2O,反应生成水,随反应进行KOH溶液浓度降低,溶液PH值减小.
解答 解:A、已知:①N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
②2N2H4(g)+2NO2(g)=3N2(g)+4H2O (g)△H=-1 135.7kJ/mol;
由盖斯定律,①+②得2N2H4(g)+2O2(g)=2N2(g)+4H2O(g)△H=67.7kJ/mol-1135.7kJ/mol=-1068 kJ/mol.
即N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ/mol.故A错误;
B、N2H4不是电解质,N2H4•H2O是弱电解质,N2H4•H2O存在电离平衡,电离方程式为N2H4•H2O?N2H5++OH-,故B错误;
C、原电池总反应为N2H4+O2=N2+2H2O,原电池正极发生还原反应,氧气在正极放电,碱性条件下,正极电极反应式为O2+2H2O+4e-=4OH-,总反应式减去正极反应式可得负极电极反应式为N2H4-4e-+4OH-=N2+4H2O,故C正确;
D、原电池总反应为N2H4+O2=N2+2H2O,反应生成水,随反应进行KOH溶液浓度降低,碱性减弱,溶液PH值减小,故D错误.
故选C.
点评 考查盖斯定律、热化学方程式书写、弱电解质的电离、原电池工作原理与电极反应式书写,难度中等,注意利用正、负电极反应式之和等于总反应式书写电极反应式.


科目:高中化学 来源: 题型:选择题
| A. | 在pH=11的溶液中,K+、Cl-、HSO3-、Na+可以大量共存 | |
| B. | 在pH=0的溶液中,Na+、NO3-、Fe2+、K+可以大量共存 | |
| C. | 常温下,由0.1 mol•L-1一元碱BOH溶液的pH=10,可知BOH溶液中存在BOH?B++OH- | |
| D. | 常温下,由0.1 mol•L-1一元酸HA溶液的pH=3,可推知NaA溶液中存在A-+H2O=HA+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol/L | B. | 1 mol/L | C. | 3 mol/L | D. | 4 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
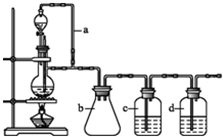

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
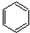 +CH3Cl$\stackrel{AlCl_{3}}{→}$
+CH3Cl$\stackrel{AlCl_{3}}{→}$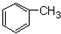 +HCl
+HCl| A. | CH3CH3和Cl2 | B. | CH2=CH2和Cl2 | C. | CH2=CH2和HCl | D. | CH3CH3和HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子序数:X<Y<Z | B. | 气态氢化物稳定性:XH3<YH3<ZH3 | ||
| C. | 元素的非金属性强弱:X>Y>Z | D. | 电子层数:X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
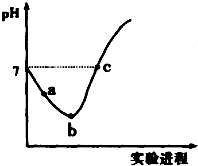 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1的NaOH溶液,整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1的NaOH溶液,整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )| A. | 向a点所示溶液中通入SO2,溶液的酸性和漂白性均增强 | |
| B. | b点所示的溶液中:c(H+)>c(Cl-)>c(ClO-)>c(HClO) | |
| C. | 由a点到b点的过程中,溶液中$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小 | |
| D. | c 点所示溶液中:c(Na+)=2c(ClO-)+c(HClO) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com