
| A. | CO的燃烧热为283 kJ | |
| B. | 图可表示由CO生成CO2的反应过程和能量关系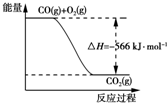 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H=-452 kJ•mol-1 | |
| D. | CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为1.204×1024 |
分析 A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,单位为KJ/mol;
B.由热化学方程式可知,1molCO完全燃烧放出热量283kJ;
C.反应热与化学计量数成正比关系,气体物质的能量比固体能量高;
D.已知:①2CO(g)+O2(g)=2CO2(g);△H=-566kJ/mol
②Na2O2(s)+CO2(g)=Na2CO3(s)+$\frac{1}{2}$O2(g);△H=-226kJ/mol
根据盖斯定律,②×2+①可得:2CO(g)+2Na2O2(s)=2 Na2CO3(s)△H=-1018kJ/mol,根据反应计算参加反应CO物质的量,再根据C元素化合价变化计算转移电子.
解答 解:A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,单位为KJ/mol,由2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1,可知CO的燃烧热为283kJ/mol,故A错误;
B.由热化学方程式可知,1molCO燃烧放出热量为283kJ,图象中的焓变应是2molCO燃烧的反应热,图象中物质的量和焓变不统一,故B错误;
C.热化学方程式为2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=-452kJ/mol,二氧化碳气体变化为固体放热,△H<-452kJ/mol,故C错误;
D.已知:①2CO(g)+O2(g)=2CO2(g);△H=-566kJ/mol
②Na2O2(s)+CO2(g)=Na2CO3(s)+$\frac{1}{2}$O2(g);△H=-226kJ/mol
根据盖斯定律,②×2+①可得:2CO(g)+2Na2O2(s)=2 Na2CO3(s)△H=-1018kJ/mol,CO(g)与Na2O2(s)反应放出509kJ热量时,参加反应CO为2mol×$\frac{509kJ}{1018kJ}$=1mol,反应的电子转移数为2mol,即电子转移数为1.204×1024,故D正确,
故选:D.
点评 本题考查燃烧热、热化学方程式、反应热计算、盖斯定律应用等,注意对基础知识的理解掌握,有利于基础知识的巩固.


科目:高中化学 来源: 题型:填空题
 、
、 .
.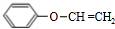 .
.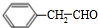 、
、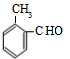 、
、 、
、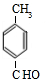 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 铜片上有气泡产生 | B. | 锌片逐渐溶解 | ||
| C. | 溶液逐渐变蓝 | D. | 电流计指针发生偏转 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乳浊液 | B. | 溶液 | C. | 胶体 | D. | 悬浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8 g | B. | 6.5 g | C. | 3 g | D. | 10 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 43.2 g | B. | 46.8 g | C. | 53.6 g | D. | 63.8 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.
太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com