
(12分)工业制氢气的一个重要反应是:CO(g)+H2O(g)  CO2(g)+H2(g)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡状态所需时间/min | ||
CO | H2O | H2 | CO2 | |||
I | 650 | 4 | 2 | 1.6 | 1.6 | 5 |
II | 900 | 2 | 1 | 0.5 | 0.5 | 3 |
①对于反应CO(g)+H2O(g)  CO2(g)+H2(g),下列说法正确的是
CO2(g)+H2(g),下列说法正确的是
A.当容器中CO的含量保持不变时,说明该反应达到平衡状态
B.若混合气体的密度不再改变,说明该反应已达化学平衡状态
C.实验I中,反应达到平衡后,再通入4molCO和2molH2O,平衡正向移动,H2的体积分数增大
D.若使用催化剂,会改变反应的途径,但反应的焓变不变
②实验I中,从反应开始到反应达到平衡时,CO的平均反应速率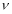 (CO)= ;
(CO)= ;
③实验II条件下反应的平衡常数K= (保留小数点后二位);H2O(g)的平衡转化率为 。
④若在900℃时,实验II反应达到平衡后,向此容器中再加入1.5molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则平衡向 方向移动(填“正反应”、“逆反应”或“不移动”)
⑤若仅改变温度,纵坐标y随T变化如图所示,则纵坐标y表示的是 。
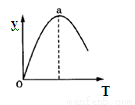
A.CO2的百分含量 B.混合气体的平均相对分子质量
C.CO的转化率 D.H2O的物质的量
(1)AD; (2)0.16mol/l/min;(3)0.33, 50% (4)正反应 (5)AC
【解析】
试题分析:①A.若容器中CO的含量保持不变,则其浓度不变,反应处于平衡状态,正确; B.由于容器的容积不变,根据质量守恒,气体的总质量不变,所以无论反应进行到任何程度,容器中混合气体的密度都不变,因此不能判断反应处于平衡状态,错误;C.体积不变,再通入4molCO和2molH2O,相当于增大压强,平衡不移动,错误;D.使用催化剂,会改变反应的途径,但反应的焓变不变,正确。②实验I中,从反应开始到反应达到平衡时,CO的平均反应速率V(CO)=(1.6mol÷2L)÷5min=0.16mol/(L·min); ③实验II条件下反应的平衡常数K=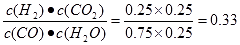 ;H2O(g)的平衡转化率=
;H2O(g)的平衡转化率=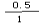 ×100℅=50%④若在900℃时,实验II反应达到平衡后,向此容器中再加入1molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则此时由于Q=
×100℅=50%④若在900℃时,实验II反应达到平衡后,向此容器中再加入1molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则此时由于Q=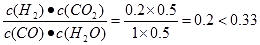 ,所以
,所以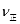 >
>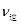 (填“”或“<”),平衡向向正反应方向移动。⑤由图像看出o-a反应未达平衡,a以后升高温度y减小,由表可知升高温度平衡逆向移动,A.CO2的百分含量减小,正确;B.由于容器的容积不变,气体的物质的量不变,所以无论反应进行到任何程度,容器中混合气体的平均相对分子质量都不变,错误;C.CO的转化率减小,正确;D.H2O的物质的量增大,错误。
(填“”或“<”),平衡向向正反应方向移动。⑤由图像看出o-a反应未达平衡,a以后升高温度y减小,由表可知升高温度平衡逆向移动,A.CO2的百分含量减小,正确;B.由于容器的容积不变,气体的物质的量不变,所以无论反应进行到任何程度,容器中混合气体的平均相对分子质量都不变,错误;C.CO的转化率减小,正确;D.H2O的物质的量增大,错误。
考点:考查可逆反应平衡状态的判断、化学反应速率、化学平衡的计算、物质转化率的大小比较和影响因素、化学反应进行的方向的判断的知识。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源:2014-2015学年广东省东莞市三校高二上学期期中联考化学试卷(解析版) 题型:选择题
对反应A(g)+3B(g)=2C(g)来说,下列反应速率中最快的是
A.v(A)=0.3 mol·L-1·min-1 B.v(B)=0.6 mol·L-1·min-1
C.v(C)=0.5 mol·L-1·min-1 D.v(A)=0.01 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高二12月月考化学试卷(解析版) 题型:选择题
历史上最早应用的还原性染料是靛蓝,其结构简式如图所示,下列关于靛蓝的叙述中错误的是
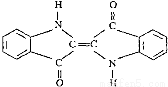
A.靛蓝由碳、氢、氧、氮四种元素组成
B.它的分子式是C16H10N2O2
C.该物质是高分子化合物
D.它是不饱和的有机物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省东莞市三校高一上学期期中联考化学试卷(解析版) 题型:选择题
能正确表示下列化学反应的离子方程式是
A.稀盐酸与铁粉反应:Fe+2H+=Fe2++H2↑
B.碳酸钡溶于醋酸:BaCO3+2H+ =Ba2++H2O+CO2↑
C.锌片插入硝酸银溶液中:Zn+2Ag+=Zn2++2Ag
D.硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省东莞市三校高一上学期期中联考化学试卷(解析版) 题型:选择题
下列溶液中的氯离子数目与50 mL 1 mol/L的AlCl3溶液中氯离子数目相等的是
A.75 mL 2 mol/L的CaCl2 B.150 mL 1 mol/L的NaCl
C.150 mL 3 mol/L的KCl D.100 mL 2 mol/L的NH4Cl
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高二上学期第二次月考化学试卷(解析版) 题型:选择题
常温下,向l00mL 0.01mol/L HA的溶液中逐滴加入0.02mol/L MOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中正确的是
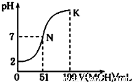
A.HA为一元强酸,MOH为一元强碱
B.N点水的电离程度小于K点水的电离程度
C.K点所示溶液中c(A-)>c(M+)
D.K点对应的溶液中,有c(MOH)+c(M+)=0.01mol/L
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高二上学期第二次月考化学试卷(解析版) 题型:选择题
下图两个装置中,溶液体积均为200mL,开始时,电解质溶液的浓度均为0.1mol/L, 工作一段时间后,测得导线上都通过了0.02mol e一,若不考虑溶液体积的变化,
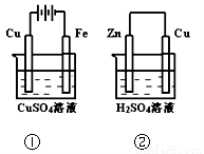
则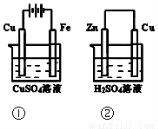 下列叙述正确的是
下列叙述正确的是
A.在①中Cu棒为阳极;在②中Cu棒为负极
B.电极上生成物质的质量:①<②
C.电极反应式:①中阳极:4OH一-4e一=2H2O+O2↑;②中负极:2H+ + 2e-= H2↑
D.溶液的pH:①不变;②增大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省校高一上学期期中化学试卷(解析版) 题型:选择题
下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是
A.氢氧化钠与盐酸;氢氧化钠与醋酸
B.BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液
C.Na2CO3溶液与硝酸溶液;CaCO3溶液与硝酸溶液
D.石灰石与硝酸;石灰石与盐酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省高二上学期期中化学试卷(解析版) 题型:填空题
(6分)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量。
(1)反应的热化学方程式为 。
(2)又已知H2O(l)=H2O(g);ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 KJ。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com