
 .
.分析 (1)双氧水中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合;
(2)镁与二氧化碳反应生成碳与氧化镁,碳能够燃烧;
(3)反应中Mn元素的化合价由+7价降低为+2价,C元素的化合价由+3价升高为+4价,依据氧化还原反应得失电子守恒规律结合原子个数守恒规律配平书写方程式.
解答 解:(1)双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为 ,故答案为:
,故答案为: ;
;
(2)镁与二氧化碳反应生成碳与氧化镁,化学方程式:2Mg+CO2$\frac{\underline{\;高温\;}}{\;}$2MgO+C,碳能够燃烧,所以镁燃烧不能用CO2灭火;
故答案为:2Mg+CO2$\frac{\underline{\;高温\;}}{\;}$2MgO+C;
(3)Mn元素的化合价由+7价降低为+2价,C元素的化合价由+3价升高为+4价,要想使氧化剂得到电子数等于还原剂失去电子数,则高锰酸根离子系数为2,草酸根离子系数为5,依据原子个数守恒,反应的方程式:
2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O;
故答案为:2;5;16H+;2;10;8H2O;
点评 本题考查了电子式、化学方程式的书写,氧化还原方程式配平,明确双氧水结构、镁的化学性质、氧化还原反应得失电子守恒规律是解题关键,侧重考查学生分析问题、解决问题能力,题目难度不大.


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:解答题

 .
. ;G的结构简式
;G的结构简式 .F1和F2互为同分异构体.
.F1和F2互为同分异构体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 500 | 1 000 | 1 500 |
| c(N2O5)/mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500 s内N2O5分解速率为2.96×10-3 mol/(L•s) | |
| B. | T1温度下的平衡常数为K2=125,1 000 s时N2O5转化率为50% | |
| C. | 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2 | |
| D. | T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1>T3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
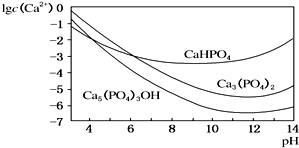 羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,其常用的制备方法有两种:
羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,其常用的制备方法有两种:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示.
(1)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的盐酸和pH=1的盐酸,c(H+)之比为2:1 | |
| B. | NH4HSO4液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2 c(SO42-) | |
| C. | 已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为Ka•Kh=Kw | |
| D. | pH相等的四种溶液:a.CH3COONa;b.Na2CO3;c.NaHCO3;d.NaOH,其溶液物质的量浓度由小到大顺序为d、b、a、c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 火药使用 | 粮食酿酒 | 转轮排字 | 铁的冶炼 |
 |  |  |  |
| 用品 |  |  |  |  |
| 有效成分 | NaCl | NaOH | NaHCO3 | Ca(ClO)2 |
| 用途 | 做调味品 | 做治疗胃病的抗酸药 | 做发酵粉 | 做消毒剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com