
【题目】将一定量的氯气通入![]() 的氢氧化钠浓溶液中,加热少许时间后,溶液中形成NaCl、NaClO、
的氢氧化钠浓溶液中,加热少许时间后,溶液中形成NaCl、NaClO、![]() 共存体系(不考虑氯气和水的反应)。下列说法正确的是
共存体系(不考虑氯气和水的反应)。下列说法正确的是
A.若反应中转移的电子为n mol,则![]()
B.溶液中![]() 可能为
可能为![]()
C.与NaOH反应的氯气物质的量:![]()
D.当溶液中![]() 时,反应的离子方程式为:
时,反应的离子方程式为:![]()
【答案】D
【解析】
![]() ,则
,则
A.氯气和NaOH反应有![]() 、
、![]() ,当生成NaCl和NaClO时转移电子最少,
,当生成NaCl和NaClO时转移电子最少,![]() 消耗
消耗![]() ,生成
,生成![]() 转移电子的物质的量为
转移电子的物质的量为![]() ;当生成NaCl和
;当生成NaCl和![]() 时,
时,![]() 消耗
消耗![]() ,生成
,生成![]() 转移电子的物质的量为
转移电子的物质的量为![]() ,所以如果反应中转移的电子为n mol,则
,所以如果反应中转移的电子为n mol,则![]() ,故A错误;
,故A错误;
B.令![]() ,
,![]() ,
,![]() ,生成NaCl获得的电子为
,生成NaCl获得的电子为![]() ,生成NaClO、
,生成NaClO、![]() 失去的电子为
失去的电子为![]() ,得失电子不相等,故B错误;
,得失电子不相等,故B错误;
C.若氯气和NaOH只发生反应![]() ,则消耗氯气为
,则消耗氯气为![]() ,若只发生反应
,若只发生反应![]() ,消耗的氯气为
,消耗的氯气为![]() ,所以与NaOH反应的氯气物质的量为
,所以与NaOH反应的氯气物质的量为![]() ,故C错误;
,故C错误;
D.当溶液中![]() :
:![]() :1时,则Cl原子失去的电子数为10,生成NaCl得到的电子数为1,所以NaCl的计量数为10,反应的离子方程式为:
:1时,则Cl原子失去的电子数为10,生成NaCl得到的电子数为1,所以NaCl的计量数为10,反应的离子方程式为:![]() ,故D正确;
,故D正确;
故答案选D。


科目:高中化学 来源: 题型:
【题目】一定温度下在容积恒定的密团容器中发生反应A(s)+2B(g)![]() C(g)+D(g)。下列不能说明反应一定达到化学平衡状态的是
C(g)+D(g)。下列不能说明反应一定达到化学平衡状态的是
A. v正(B)=2v逆(C) B. 每消耗1molC,同时生成1molD
C. 气体的密度保持不变 D. B、C、D三种物质的浓度之比为2:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质在水溶液中的水解离子方程式及沉淀溶解平衡方程式:
(1)NaClO水解离子方程式___________________________
(2)NH4Cl水解离子方程式____________________________
(3)KAl(SO4)2·12H2O水解离子方程式__________________________
(4)CaCO3沉淀溶解平衡方程式__________________________
(5)Fe(OH)3沉淀溶解平衡方程式__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果.设计如下对比实验探究温度、浓度、pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示,下列说法不正确的是( )
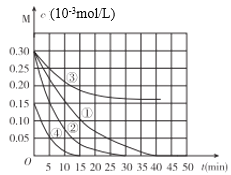
实验编号 | 温度°C | pH |
① | 25 | 1 |
② | 45 | 1 |
③ | 25 | 7 |
④ | 25 | 1 |
A.实验①在15min内M的降解速率为1.33×10-5mol/(L·min)
B.若其他条件相同,实验①②说明升高温度,M降解速率增大
C.若其他条件相同,实验①③证明pH越高,越不利于M的降解
D.实验①④说明M的浓度越小,降解的速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的第三周期元素,已知A、B、E3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)D的原子结构示意图为___;E在元素周期表中的位置为___。
(2)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示)___。
(3)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:___。
(4)写出A、B两元素最高价氧化物的水化物反应的化学方程式:___。
(5)E单质与水反应时,每1molE单质完全反应转移的电子数为___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅是一种化工原料,可以制备一系列物质。下列说法正确的是( )
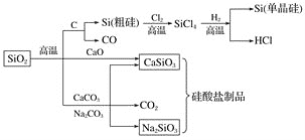
A.图中所有反应都不属于氧化还原反应
B.硅酸盐的化学性质稳定,常用于制造光导纤维
C.可用盐酸除去石英砂(主要成分为SiO2)中少量的碳酸钙
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】个化学反应,我们不但关心物质变化和能量变化,还通常要研究化学反应的快慢
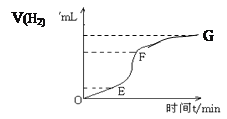
(1)用纯净的锌粒和盐酸反应制取氢气,回答:
实验过程如下图所示,分析判断:________段化学反应速率最快,原因是___________________,_______段收集的氢气最多。
为了加快上述反应的速率,欲向溶液中加入一定量下列物质,你认为可行的是________
A.胆矾晶体 B.硫酸氢钠固体
C.氯化锌浓溶液 D.浓硝酸
除了上述方法外,你认为还可以采取____________________措施来加快化学反应速率。
(2)下图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是达到平衡状态的时间。
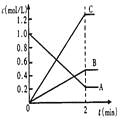
试回答
①该反应的化学方程式为_________________________________。
②达到平衡状态的所需时间是2min,A物质的平均化学反应速率为_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于固定体积的密闭容器中进行的反应:A(g)+B(g)![]() C(g)+2D(g),不能说明在恒温下可逆反应已经达到平衡状态的是
C(g)+2D(g),不能说明在恒温下可逆反应已经达到平衡状态的是
①反应容器中压强不随时间变化而变化
②单位时间内生成A的物质的量与消耗D的物质的量之比为1:2
③混合气体的平均摩尔质量不随时间变化而变化
④反应混合气体的密度不随时间变化而变化
A. ②④ B. ③④ C. ①③ D. ①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.密闭容器中,1molN2和3molH2催化反应后分子总数为2NA
B.100g98%的浓H2 SO4与过量的Cu反应后,电子转移数为NA
C.标准状况下,11.2L氧气和二氧化碳混合物中含氧原子数目为NA
D.1L1mol/LNa2CO3溶液中所含阴离子数目小于NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com