
| A、N、O、S |
| B、Cl、N、P |
| C、Be、F、Cl |
| D、F、N、P |
| 15 |
| 2 |
| 13 |
| 2 |
| 11 |
| 2 |
| 9 |
| 2 |


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
A、N2+3H2
| ||||||||
B、H2+I2
| ||||||||
C、2H2+O2
| ||||||||
D、2SO2+O2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 用途或现象 | 体现浓硫酸的性质 |
| (1)浓硫酸使胆矾由蓝色变成白色 | |
| (2)将浓硫酸滴在一张纸片上发现纸片变黑. | |
| (3)铜与浓硫酸加热,溶液变蓝并产生有刺激性气味的气体 | |
| (4)浓硫酸作为干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能生成碱的金属元素都在ⅠA族 |
| B、稀有气体元素原子的最外层电子数均为8 |
| C、第二周期ⅣA族元素的原子核电荷数和种子数一定为6 |
| D、原子序数为14的元素位于元素周期表的第3周期ⅣA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
35 17 |
37 17 |
 与
与  ⑥CH3-CH2-OH和CH3-O-CH3
⑥CH3-CH2-OH和CH3-O-CH3查看答案和解析>>
科目:高中化学 来源: 题型:
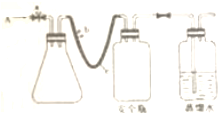 实验室用下列方法测定某水样中O2的含量
实验室用下列方法测定某水样中O2的含量2- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下“纳米铜”比铜片的还原性强,反应时反应速率快 |
| B、“纳米铜”颗粒更细小,化学反应时接触面大,所以反应速率快 |
| C、“纳米铜”与铜是同素异形体 |
| D、常温下“纳米铜”比铜片更易得电子,反应时反应速率快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com