
| A. | 铅蓄电池放电时,正极和负极的电极质量均增大 | |
| B. | 反应Cl2(g)+H2O(1)=HCl(aq)+HClO(aq)在常温下能自发进行,则该反应的△H<0 | |
| C. | 在N2(g)+3H2(g)?2NH3(g)平衡体系中加入催化剂,N2的反应速率和转化率均增大 | |
| D. | C2H5Br水解生成乙醇(△H>0),加入少量NaOH浓溶液并加热,该化学反应速率增大其平衡常数不变 |
分析 A.铅蓄电池在放电过程中,负极Pb转化为硫酸铅;
B.该反应为熵减的反应,能在常温下自发进行,那么一定为焓变小于0的反应,即放热反应;
C.催化剂对转化率无影响;
D.平衡常数只与温度有关,温度改变,平衡常数变化.
解答 解:A.铅蓄电池在放电过程中,负极Pb转化为硫酸铅,硫酸铅难溶于硫酸,则生成的硫酸铅附着在负极,使负极的质量增大,放电时,正极上二氧化铅得电子和氢离子反应生成硫酸铅和水,正极质量也增大,故A正确;
B.该反应为熵减的反应,能在常温下自发进行,那么一定为焓变小于0的反应,即放热反应:△H<0,故B正确;
C.在N2(g)+3H2(g)?2NH3(g)平衡体系中加入催化剂,N2的反应速率增大,催化剂对化学平衡移动无影响,所以转化率不变,故C错误;
D.C2H5Br水解生成乙醇(△H>0),加入少量NaOH浓溶液并加热,加热温度改变,平衡常数改变,故D错误,
故选AB.
点评 本题综合性较强,考查的是原电池与电解池工作原理、反应自发性的判断、影响反应速率和化学平衡移动的因素,侧重于基础知识的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应 | |
| B. | 苯酚能与溴水反应,苯不能与溴水反应 | |
| C. | 甲苯能使酸性高锰酸钾溶液褪色,苯不能使酸性高锰酸钾溶液褪色 | |
| D. | 甲苯与溴蒸气(光照)发生取代反应,苯与液溴(铁做催化剂)发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(B2)=0.8mol(L•s)-1 | B. | v(A2)=0.4 mol(L•s)-1 | ||
| C. | v(C)=0.6 mol(L•s)-1 | D. | v(D)=0.1 mol(L•s)-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
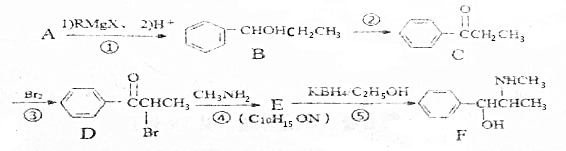
 (R、R′、R″均代表烃基;X代表卤素原子);
(R、R′、R″均代表烃基;X代表卤素原子); .
. .反应⑤的反应类型为还原反应.
.反应⑤的反应类型为还原反应. .
. (写反式结构)
(写反式结构)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com