
| A. | 0.0008mol/L | B. | 0.00125mol/L | C. | 0.8mol/L | D. | 1.25mo/L |
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 84% | B. | 42% | C. | 53% | D. | 67% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2、CH4、氟氯代烃等都会造成温窒效应,因此都属于大气污染物 | |
| B. | 测定某地区的酸雨发现经过一段时间之后pH下降,判断为硝酸型酸雨 | |
| C. | 低碳经济主要与工厂、汽车排放有关,与人们用电、用水、用纸等是否节约无关 | |
| D. | 绿色化学的核心是利用化学原理对环境污染进行治理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H8O2 | B. | C5H10O2 | C. | C6H12O2 | D. | C7H14O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 800 | 54.0 | a | b |
| 900 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
| A. | 4个 | B. | 3个 | C. | 2个 | D. | 1个 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
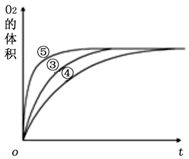 实验小组用0.50mol/L KOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
实验小组用0.50mol/L KOH溶液和0.50mol/L硫酸溶液进行中和热的测定.| 项目 数据 次数 | 起始温度T1/℃ | 终止温度T2/℃ | 温度差平均值 (T2-T1)/℃ | ||
| H2SO4 | KOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 |
| 2 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 3 | 26.4 | 26.2 | 26.3 | 30.4 | |
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | 10 mL 5% H2O2溶液 | 无 |
| ③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol•L-1 X溶液 |
| ④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol•L-1 X溶液 |
| ⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol•L-1 X溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2=CHCOOH能发生加成、取代、氧化反应 | |
| B. | 油脂、淀粉、纤维素都属于天然高分子化合物 | |
| C. | 蛋白质溶液加入CuSO4溶液会析出,这一过程属于蛋白质的盐析 | |
| D. | 甲苯和乙烯都可与溴水发生化学反应使溴水褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com