
【题目】工业上有一种用CO2生产甲醇燃料的方法:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。某实验中将6 mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图曲线 (甲)所示。请完成下列问题:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。某实验中将6 mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图曲线 (甲)所示。请完成下列问题:
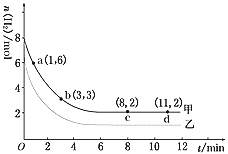
(1)a点正反应速率________逆反应速率(填“>”、“<”或“=”)。
(2)若仅改变某一实验条件再进行一次实验,测得H2的物质的量随时间变化如图中虚线(乙)所示,曲线(乙)对应改变的实验条件可以是________(填序号)。
a.加催化剂 b.增大压强 c.升高温度 d.增大H2浓度
【答案】> b
【解析】
CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.0kJ/mol,该反应的正反应为气体体积减小的放热反应; a点时还没有达到平衡状态,反应物氢气的物质的量继续减小,平衡向正向移动;增大压强或增大H2浓度可以使平衡向正反应方向移动;使用催化剂可以加快反应速率,但平衡不发生移动;升高温度可加快反应速率,平衡向逆反应方向移动,据此分析;
(1)a点时还没有达到平衡状态,根据CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol可知,反应物氢气的物质的量继续减小,反应正向进行,所以正反应速率大于逆反应速率,故答案为:>;
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol可知,反应物氢气的物质的量继续减小,反应正向进行,所以正反应速率大于逆反应速率,故答案为:>;
(2)a.加催化剂,平衡不移动,平衡时氢气的物质的量相等,与图象不符,故a错误;
b.增大压强,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的平衡正向移动,氢气的物质的量减小,与图象相符,故b正确;
CH3OH(g)+H2O(g)的平衡正向移动,氢气的物质的量减小,与图象相符,故b正确;
c.由CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol可知升高温度,平衡逆向移动,平衡时氢气的物质的量增大,与图象不符,故c错误;
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol可知升高温度,平衡逆向移动,平衡时氢气的物质的量增大,与图象不符,故c错误;
d.增大H2浓度,尽管平衡正向移动,但平衡时氢气的物质的量仍增大,与图象不符,故d错误;
答案选b。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】如图所示:
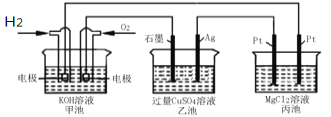
下列说法正确的是
A.甲池通入O2的电极反应为O2 + 4e-+ 4H+=2H2O
B.乙池 Ag电极增重6.4g,溶液中将转移0.2mol电子
C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度
D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
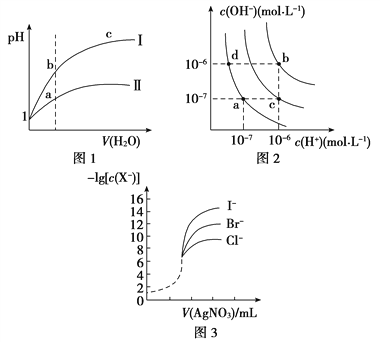
A. 图1表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
B. 图2中纯水仅升高温度,就可以从a点变到c点
C. 图2中在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性
D. 用0.010 0 mol/L硝酸银标准溶液,滴定浓度均为0.100 0 mol/L Cl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在生产,生活中有着重要的作用。
(1)将大气中游离态的氮转为化合态的过程称为氮的固定。下表列举了不同温度下大气固氮和工业固氮的部分K值。
反应 | 大气固氮 | 工业固氮 | |||
温度/℃ | 27 | 2000 | 25 | 400 | 450 |
K |
| 0.1 |
| 0.507 | 0.152 |
分析数据可知:大气固氮反应属于_________(填“吸热”或“放热”)反应,人类不适合大规模模拟大气固氮的原因是______________________________________。
(2)液氨是一种良好的储氢物质,其储氢容量可达17.6%(质量分数)。氨气分解反应的热化学方程式如下:![]() 。研究表明金属催化剂可加速氨气的分解,其他条件相同,该反应在不同催化剂作用下反应相同时间后,氮气的百分含量随反应温度的变化如图所示,图中达到平衡的点是_______________(用a、b、c表示)。b点氮气的百分含量高于c点的原因是______。
。研究表明金属催化剂可加速氨气的分解,其他条件相同,该反应在不同催化剂作用下反应相同时间后,氮气的百分含量随反应温度的变化如图所示,图中达到平衡的点是_______________(用a、b、c表示)。b点氮气的百分含量高于c点的原因是______。

(3)近年来,有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为![]() ,该条件下,向一体积为
,该条件下,向一体积为![]() 的恒容密闭容器中通入
的恒容密闭容器中通入![]() 和
和![]() ,
,![]() 后达到平衡。测得氨气的生成速率
后达到平衡。测得氨气的生成速率![]() ,则平衡时
,则平衡时![]() 的转化率为______________,则常温下该反应的化学平衡常数
的转化率为______________,则常温下该反应的化学平衡常数![]() ________________。(保留小数点后2位)
________________。(保留小数点后2位)
(4)汽车尾气会排放氮的氧化物,是造成雾霾天气的重要原因之一。可以在汽车排气管上安装一个化转化器处理尾气:![]() ,将
,将![]() 与
与![]() 以2∶1的起始投料比充入一个密闭容器中,发生反应,反应过程中各物质的浓度变化如图所示。由图分析可知,第
以2∶1的起始投料比充入一个密闭容器中,发生反应,反应过程中各物质的浓度变化如图所示。由图分析可知,第![]() 时改变的反应条件可能为____________(填序号)。
时改变的反应条件可能为____________(填序号)。

A.保持恒温恒容充入![]() 气
气
B.保持恒容,降低温度
C.移走![]()
D.保持恒温,缩小容器体积,增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子方程式书写或离子共存说法正确的是
A.在0.1mol/LNa2CO3溶液中:Al3+、NH4+、SO42-、NO3-一定能大量共存
B.常温下,![]() =0.1mol/L的溶液中,下列离子一定能大量共存:K+、Cl-、Fe2+、NO3-
=0.1mol/L的溶液中,下列离子一定能大量共存:K+、Cl-、Fe2+、NO3-
C.清洗锅炉时先用纯碱溶液浸泡的主要原因:CaSO4(s)+CO32-(aq)SO42-(aq)+CaCO3(s)
D.向Al2(SO4)3溶液中加入少量Ba(OH)2溶液:Ba2++SO42-+Al3++3OH-=BaSO4↓+Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定的![]() 、
、![]() 合金置于水中,结果合金完全溶解,得到20mL、pH=14的溶液,然后用1mol/L的盐酸滴定至沉淀最大时,消耗40mL盐酸。原合金中
合金置于水中,结果合金完全溶解,得到20mL、pH=14的溶液,然后用1mol/L的盐酸滴定至沉淀最大时,消耗40mL盐酸。原合金中![]() 的物质的量( )
的物质的量( )
A.0.01molB.0.02molC.0.03molD.0.04mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应NO2+NH3→N2+H2O(未配平)消除NO2的简易装置如图所示。下列说法不正确的是( )
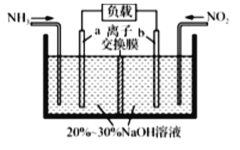
A.a电极反应式是![]()
B.消耗标准状况下![]() 时,被消除的NO2的物质的量为
时,被消除的NO2的物质的量为![]()
C.若离子交换膜是阳离子交换摸,装置右室中溶液的碱性增强
D.整个装置中NaOH的物质的量不断减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废铅蓄电池填料(主要成分为PbO2、PbO、PbSO4等)作阴极,采取固相直接电解法可提取金属Pb,其装置如图所示(已知:PbSO4+3OH-=HPbO2-+S042-+H2O)。下列说法中错误的是
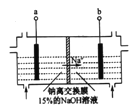
A. b与外接电源的负极相连
B. PbO2放电时电极反应式为:PbO2+4e-+2H2O=Pb+40H-
C. 电解过程中左室水的电离程度减弱(忽略溶液温度变化)
D. 与传统无膜电解法相比,该电解方法可提高铅元素利用率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com