
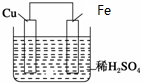
 如图是Fe和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )
如图是Fe和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )| A. | ①②③ | B. | ③④ | C. | ③④⑤ | D. | ③④⑥ |
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,33.6LCHCl3的分子数为1.5NA | |
| B. | 4.6g乙醇含极性共价键的数目为0.8NA | |
| C. | 4.2g由C2H4和C4H8组成的混合物中含碳原子的数目为0.3NA | |
| D. | 1L0.1mol•L-1的醋酸溶液中含H+数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 电池放电时,负极周围溶液的pH不断增大 | |
| B. | 电池放电时总反应是Cd+2NiO(OH)+2H2O═Cd(OH)2+2Ni(OH)2 | |
| C. | 电池充电时,镉(Cd)元素被氧化 | |
| D. | 电池充电时,电池的正极和电源的正极相连接 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
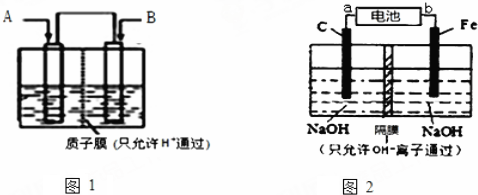
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na最外层有一个电子,Mg最外层有2个电子 | |
| B. | Na能与冷水反应,而Mg不能 | |
| C. | 碱性NaOH>Mg(OH)2 | |
| D. | Na不能从MgCl2的溶液中把Mg置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂在碱性条件下发生皂化反应 | |
| B. | 淀粉水解的最终产物是葡萄糖 | |
| C. | 葡萄糖、蔗糖、麦芽糖都能发生银镜反应 | |
| D. | 蛋白质水解的最终产物都是氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式: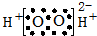 | B. | F-的结构示意图: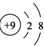 | ||
| C. | 中子数为20 的氯原子:2017Cl | D. | NH3的电子式: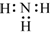 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com