
汞(Hg)、铬(Cr)是影响环境污染、生物效应和人类健康的重金属元素。
I、铬广泛应用于钢铁工业、磁带和录像带等方面。
(1)工业常采用“铝在高温条件下还原铬绿(Cr2O3)”制备铬单质,该反应的化学方程式为 。
II、含铬的工业废水会导致慢性中毒。处理含+6价铬的废水时可得到铁氧体(其组成可写作[Fe2+Fe3+(2-x) Cr3+x]O4)。

(2)加过量FeSO4的目的是 。
(3)配平步骤①的反应的离子方程式 Fe2++ Cr2O72—+ _____== Fe3++ Cr3++ H2O
并计算铁氧体( [Fe2+Fe3+(2-x) Cr3+x]O4)中X= _________________。
(4)下表是实验检测中心对某地区二个点的土壤样品(每个点分三层取样,共6个样品)进行了有机质和铬总量的测定,结果见下表。
|
样品序号 |
取样深度(m) |
有机质(×10—2g) |
总铬(×10—6g) |
|
样品A-1 |
0.00 ~ 0.30 |
2.81 |
114 |
|
样品A-2 |
0.30 ~ 0.60 |
1.72 |
111 |
|
样品A-3 |
1.20 ~ 1.80 |
1.00 |
88 |
|
样品B-1 |
0.00 ~ 0.30 |
2.60 |
116 |
|
样品B-2 |
0.30 ~ 0.60 |
2.48 |
112 |
|
样品B-3 |
1.20 ~ 1.80 |
1.83 |
106 |
从表中你可以得出的结论有 (答一点即可)。
(5)工业上以铬酸钾(K2CrO4)为原料,电化学法制备重铬酸钾,装置如图。反应为:4K2CrO4+4H2O 2K2Cr2O7+4KOH+2H2↑+O2↑已知K2CrO4铬酸钾溶液中存在平衡:2CrO42-(黄色)+2H+
2K2Cr2O7+4KOH+2H2↑+O2↑已知K2CrO4铬酸钾溶液中存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O通电后阳极区溶液由 变为
。原因是
。
Cr2O72-(橙色)+H2O通电后阳极区溶液由 变为
。原因是
。

(15分)(1)2Al + Cr2O3 2Cr+Al2O3(3分)
2Cr+Al2O3(3分)
(2)还原Cr2O72—,为铁氧体提供Fe2+(2分)
(3)6;1;14H+;6;2;7(2分) 0.5(2分)
(4)随着取样深度加深,有机质的含量减少、总铬量也减少;或者有机质的污染来源于人为更大;(2分)(其他合理答案均可)
(5)黄色
(1分);橙色(1分);阳极发生4OH——4e—==2H2O+O2↑,c(H+)增大,使2CrO42-(黄色)+2H+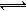 Cr2O72-(橙色)+H2O平衡向右移动(2分)
Cr2O72-(橙色)+H2O平衡向右移动(2分)
【解析】
试题分析:(1)由铝热反应类推可得,2Al + Cr2O3 2Cr+Al2O3;(2)过量硫酸亚铁的目的是将Cr2O72—还原为Cr3+,为铁氧体提供Fe2+;(3)由电子、电荷、原子守恒可知,6Fe2++Cr2O72—+14H+==6Fe3++2Cr3++7H2O;由6Fe2++Cr2O72—+14H+==6Fe3++2Cr3++7H2O可知,(2—x)/x=6/2,则x=0.5;(4)读表可知,随着取样深度加深,有机质的含量减少、总铬量也减少;或者有机质的污染来源于人为更大;(5)由题意可知,阳极反应式为4OH——4e—==2H2O+O2↑,则阳极区c(OH—)减小,使2CrO42-(黄色)+2H+
2Cr+Al2O3;(2)过量硫酸亚铁的目的是将Cr2O72—还原为Cr3+,为铁氧体提供Fe2+;(3)由电子、电荷、原子守恒可知,6Fe2++Cr2O72—+14H+==6Fe3++2Cr3++7H2O;由6Fe2++Cr2O72—+14H+==6Fe3++2Cr3++7H2O可知,(2—x)/x=6/2,则x=0.5;(4)读表可知,随着取样深度加深,有机质的含量减少、总铬量也减少;或者有机质的污染来源于人为更大;(5)由题意可知,阳极反应式为4OH——4e—==2H2O+O2↑,则阳极区c(OH—)减小,使2CrO42-(黄色)+2H+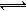 Cr2O72-(橙色)+H2O的平衡右移,溶液由黄色变为橙色。
Cr2O72-(橙色)+H2O的平衡右移,溶液由黄色变为橙色。
考点:考查铝热反应、氧化还原反应、离子方程式、物质的量在化学方程式计算中的应用、电解原理、化学平衡等相关知识。


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源:同步题 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com