
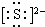 K+.
K+.| 离子半径 | 非金属性 | 酸性 | 沸点 |
| F+<D2- | A<B | D的最高价氧化物的水化物<E的最高价氧化物的水化物 | C的氢化物>E的氢化物 |
分析 A、B、C在周期表中相邻,且三种元素的原子最外层电子数之和为18,应为同周期相邻元素,且分别位于周期表第ⅤA、ⅥA、ⅦA元素,应分别为N、O、F元素,B、D同主族,则D为S元素,D、E同周期,则E为Cl元素,F是其所在周期中最活泼的金属元素,由元素序数关系可知F为K元素,结合对应单质、化合物的性质以及元素周期率解答该题.
解答 解:A、B、C在周期表中相邻,且三种元素的原子最外层电子数之和为18,应为同周期相邻元素,且分别位于周期表第ⅤA、ⅥA、ⅦA元素,应分别为N、O、F元素,B、D同主族,则D为S元素,D、E同周期,则E为Cl元素,F是其所在周期中最活泼的金属元素,由元素序数关系可知F为K元素,
(1)A为N元素,位于周期表第二周期、ⅤA族,D与F形成的最简单离子化合物为K2S,电子式为K+ 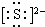 K+,
K+,
故答案为:第二周期、ⅤA族;K+ 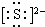 K+;
K+;
(2)K+、S2-具有相同的核外电子排布,核电荷数越大离子半径越小,则离子半径K+<S2-,同周期元素从左到右非金属性逐渐增强,则N<O,因非金属性Cl>S,则S的最高价氧化物的水化物小于Cl的最高价氧化物的水化物,非金属性F>Cl,元素的非金属性越强,对应的氢化物越稳定,则HF>HCl,
故答案为:<;<;<;>;
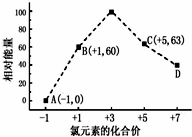
(3)①由图可知,d中Cl元素的化合价为+7价,则d为ClO4-,故答案为:ClO4-;
②结合Cl元素的化合价可知b→a+c反应为3ClO-=ClO3-+2Cl-,生成1molc时能量变化为3×60kJ-63kJ-0=117kJ,反应物总能量大于生成物总能量,该反应放出117kJ热量,故答案为:3ClO-=ClO3-+2Cl-;放热.
点评 本题考查位置结构性质关系及其应用,为高频考点,侧重对化学用语以及学生分析与迁移应用能力的考查,注意图象的分析与应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 11种 | B. | 13种 | C. | 14种 | D. | 16种 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
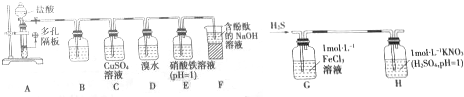
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
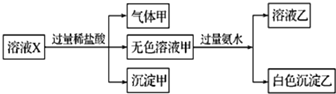
| A. | 气体甲一定是纯净物 | |
| B. | 沉淀甲是硅酸和硅酸镁的混合物 | |
| C. | K+、AlO2-和SiO32-一定存在于溶液X中 | |
| D. | 仅凭以上实验不能确定SO42-是否存在于溶液X中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
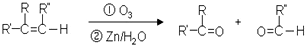
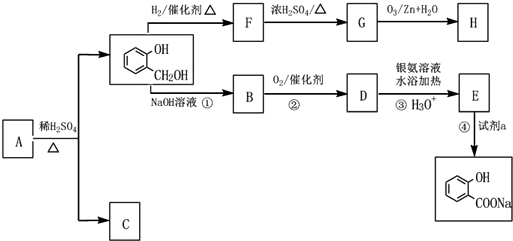
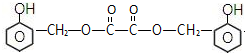 ,C俗称为草酸;
,C俗称为草酸;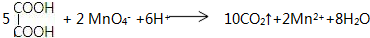 ; 写出C与对苯二甲醇在一定条件下发生缩聚反应的化学反应方程式:
; 写出C与对苯二甲醇在一定条件下发生缩聚反应的化学反应方程式: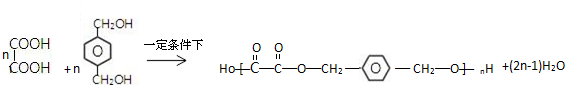 ;
; ;
; ;
;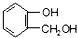 不能发生缩聚反应
不能发生缩聚反应 到F反应是否进行完全,可用FeCl3溶液检验
到F反应是否进行完全,可用FeCl3溶液检验 ;
;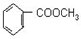 的最佳路线流程图(不参考答案能选用其他任何有机试剂,无机试剂任选). 流程图示例如下:
的最佳路线流程图(不参考答案能选用其他任何有机试剂,无机试剂任选). 流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Ag+ Ba2+ A13+ |
| 阴离子 | OH- C1- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将胆矾加热除去结晶水后,称取32 g溶解在1 L水里 | |
| B. | 称取胆矾50 g,溶解在1 L水里 | |
| C. | 将32 g胆矾溶于水,然后将此溶液稀释至1 L | |
| D. | 将50 g胆矾溶于水,然后将此溶液稀释至1 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Ⅰ | Ⅱ | |
| A | 在淀粉KI试纸上滴几滴的FeCl3溶液,试纸变蓝 | 2Fe3++2I-=I2+2Fe2+ |
| B | 铝条置于火焰加热,看到铝熔化欲滴落,却又很快凝固 | 加热时,与O2发生反应,反应吸热 |
| C | 钠投到煤油和水的混合物中,钠粒在分界处作跳动和游动 | 钠的密度比水小比煤油大,能与水反应产生H2 |
| D | 一试管内有2V的Cl2,倒置于水中,在强光充分照射,最后试管中气体变为无色,体积为V | 因为反应Cl2+H2O?HCl+HClO 和2HClO$\stackrel{光照}{?}$2HCl+O2↑ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com