
科目:高中化学 来源: 题型:解答题
 完成下列各题:
完成下列各题:| 容器 | 反应速率 | 容器 | 反应速率 |
| 甲 | v(X)=3.5mol•L-1•min-1 | 乙 | v(Y)=2 mol•L-1•min-1 |
| 丙 | v(Z)=4.5mol•L-1•min-1 | 丁 | v(X)=0.075mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠与盐酸反应 OH-+H+=H2O | |
| B. | 用稀硫酸清除铁锈 Fe2O3+6H+=2Fe3++3H2O | |
| C. | 食盐水中滴加硝酸银溶液 Cl-+Ag+=AgCl↓ | |
| D. | 氢氧化钡跟硫酸铜溶液反应 Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
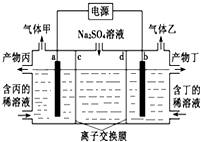 电解硫酸钠溶液生产硫酸和烧碱溶液的装置如下图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是( )
电解硫酸钠溶液生产硫酸和烧碱溶液的装置如下图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是( )| A. | a极与电源的负极相连 | B. | a电极反应式:2H2O+2e-=H2↑+2OH- | ||
| C. | 离子交换膜d为阴离子交换膜 | D. | 产物丙为硫酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Cl02气体是一种常用的消毒剂,我国从2000年起逐步用Cl02代替氯气对饮用水进行消毒.但二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热.
Cl02气体是一种常用的消毒剂,我国从2000年起逐步用Cl02代替氯气对饮用水进行消毒.但二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com