
【题目】下列关于物质分类的说法正确的是( )
A. 胆矾、石膏、漂白粉都是纯净物
B. 氢氧化钙、HCl溶液、硫酸铜均为强电解质
C. 氯化钙、烧碱、聚苯乙烯均为化合物
D. 稀豆浆、鸡蛋清溶液、雾均为胶体
科目:高中化学 来源: 题型:
【题目】0.1 mol/LNaOH和0.1 mol/LNH4Cl溶液等体积混合后,离子浓度大小的正确顺序是
A.c(Na+)>c(Cl-)>c(OH-)>c(H+) B.c(Na+)=c(Cl-)>c(OH-)>c(H+)
C.c(Na+)=c(Cl-)>c(H+)>c(OH-) D.c(Cl-)>c(Na+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),已知电离平衡常数:CH3COOH>H2CO3>C6H5OH >HCO![]() ,其中不正确的是
,其中不正确的是
A.pH相等的四种溶液:a.CH3COONab.C6H5ONac.NaHCO3d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d<b<c<a
B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
C.pH=2的一元酸和pH=12的二元强碱等体积混合:c(OH-)≤c(H+)
D.pH=4浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,不能按图示(“→”表示一步完成)关系相互转化的是
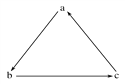
选项 | a | b | c |
A | Fe | FeCl3 | FeCl2 |
B | H2SO4 | SO2 | SO3 |
C | Si | SiO2 | H2SiO3 |
D | HNO3 | NO | NO2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解NO制备NH4NO3的工作原理如图所示,为使电解产物全部转化为NH4NO3,需要补充物质M。下列有关分析或说法中正确的是( )
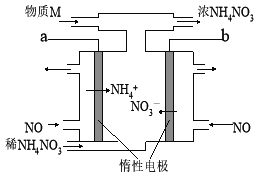
A.a应接直流电源的正极
B.阳极的电极反应式:NO+5e-+6H+=NH4++H2O
C.电路中通过5mol电子时,理论上最可处理22.4L标况下的NO
D.补充的物质M是NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研宄在其他条件不变时,改变某一条件对A2(g) +3B2 (g) ![]() AB3 (g)化学平衡状态的影响,得到如右图所示的变化规律(图中T表示温度, n表示物质的景),根据如图可得出的判断结论正确的是( )
AB3 (g)化学平衡状态的影响,得到如右图所示的变化规律(图中T表示温度, n表示物质的景),根据如图可得出的判断结论正确的是( )
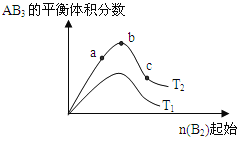
A.反应速率a>b>c
B.若T2>T1,则正反应一定是吸热反应
C.达到平衡时,AB3的物质的量大小为:b>c>a
D.达到平衡时A2的转化率大小为:b>a>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉溶液是一种胶体,并且淀粉遇到碘单质,可以出现明显的蓝色特征。现将淀粉和稀Na2SO4溶液混合,装在半透膜袋中,浸泡在盛蒸馏水的烧杯内,过一段时间后,取烧杯中液体进行实验,能证明半透膜完好无损的是( )
A.加入BaCl2溶液不产生白色沉淀
B.加入碘水不变蓝
C.加入BaCl2溶液没有白色沉淀产生
D.加入碘水变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积可变的密闭容器中,加入一定量的X、Y、Z,发生反 应mX(g) ![]() nY(g)+pZ(s) △H = Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如表所示:
nY(g)+pZ(s) △H = Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如表所示:
下列说法正确的是( )
气体体积/L c(Y)/molL-1 温度/℃ | 1 | 2 | 3 |
100 | 1.00 | 0.75 | 0.53 |
200 | 1.20 | 0.90 | 0.63 |
300 | 1.30 | 1.00 | 0.70 |
A.m>n+p
B.Q<0
C.温度不变,压强增大,Y的体积分数减少
D.体积不变,温度升高,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)对于下列反应:2SO2+O2![]() 2SO3, 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么用SO2浓度变化来表示的化学反应速率为 ,用O2浓度变化来表示的反应速率为 。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)=0.5mol/(L·min),那么2min末SO2的浓度为 。
2SO3, 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么用SO2浓度变化来表示的化学反应速率为 ,用O2浓度变化来表示的反应速率为 。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)=0.5mol/(L·min),那么2min末SO2的浓度为 。
(2)下图左表示在密闭容器中反应:2SO2+O2![]() 2SO3 H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,ab过程中改变的条件可能是 ;bc过程中改变的条件可能是 ;将增大压强时反应速率变化情况画在c—d处。
2SO3 H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,ab过程中改变的条件可能是 ;bc过程中改变的条件可能是 ;将增大压强时反应速率变化情况画在c—d处。
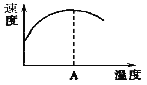
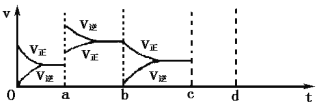
(3)酶是蛋白质,具有蛋白质的特性,酶能催化很多化学反应,上图右表示酶参加的反应中温度与反应速率的关系,解释曲线变化原因 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com