
【题目】氨广泛用于生产化肥、制冷剂等方面。回答下列问题:
(1)实验室可用下图所示装置合成氨。
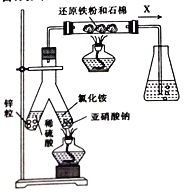
①亚硝酸钠与氯化铵反应的离子方程式为_____________________。
②锥形瓶中盛有一定量水并滴有几滴酚酞试剂。反应一段时间后,锥形瓶中溶液变红,则气体X的成分为N2、水蒸气、_____和____(填化学式)
(2)最近斯坦福大学研究人员 发明 了一种SUNCAT的锂循环系统,可持续合成氨,其原理如图所示。
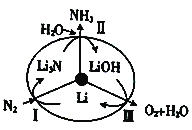
①图中反应Ⅱ属于________(填“氧化还原反应”或“非氧化还原反应”)。
②反应Ⅲ中能量转化的方式是________(填“电能转变为化学能”或“化学能转变为电能”)。
(3)液氨可用作制冷剂,液氨气化时________(填“释放”或“吸收”)能量;液氨泄漏遇明火会发生爆炸。已知部分化学键的键能数据如下表所示:
共价键 | N-H | O=O | N≡N | O-H |
键能/kJ.mol-1 | 391 | 498 | 946 | 463 |
则反应4NH3(g)+3O2(g)=2N2(g)+6H2O(g)的反应热△H=__________。
【答案】 NO2+NH4+![]() N2↑+2H2O H2 NH3 非氧化还原反应 电能转变为化学能 吸收 -1262 kJ.mol-1
N2↑+2H2O H2 NH3 非氧化还原反应 电能转变为化学能 吸收 -1262 kJ.mol-1
【解析】(1)①亚硝酸钠具有强氧化性与氯化铵发生氧化还原反应,生成氮气,反应的离子方程式为NO2+NH4+![]() N2↑+2H2O,故答案为:NO2+NH4+
N2↑+2H2O,故答案为:NO2+NH4+![]() N2↑+2H2O;
N2↑+2H2O;
②锌与稀硫酸反应生成的氢气与亚硝酸钠和氯化铵反应生成的氮气在催化剂作用下反应生成了氨气,因此锥形瓶中酚酞溶液变红,则气体X的成分为N2、水蒸气、H2、NH3,故答案为:H2、NH3;
(2)①反应Ⅱ是Li3N与水反应生成氨气的过程,反应中没有元素化合价的变化,属于非氧化还原反应,故答案为:非氧化还原反应;
②反应Ⅲ中氢氧化锂转变为锂、氧气和水,发生了氧化还原反应,属于非自发的氧化还原反应,属于电解池反应,能量转化的方式是电能转变为化学能,故答案为:电能转变为化学能;
(3)液氨可用作制冷剂,是因为液氨气化时吸收能量,导致周围温度降低;反应4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=反应物的键能之和-生成物的键能之和=391×3×4+498×3-946×2-463×2×6=-1262 kJ·mol-1,故答案为:吸收;-1262 kJ·mol-1。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列各组化合物中,氮元素具有相同化合价的是 ( )
A. NO、NO2 B. NO2、N2O C. NH3、NH4Cl D. NO2、HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组用图所示装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.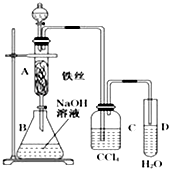
(1)写出A中反应的化学方程式 .
(2)A中铁丝的作用 .
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是 , 写出有关的化学方程式 .
(4)C中盛放CCl4的作用是 . 若证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明.另一种验证的方法是向试管D中加入 , 现象是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,能与有机物和无机物进行反应生成多种氯化物。现用下图装置制取氯气并进行一系列的实验探究。
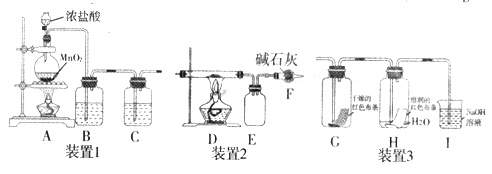
回答下列问题:
(1)装置1是用来制备纯净、干燥的氯气:
①装置A 中圆底烧瓶内发生反应的离子方程式是__________,反应中被氧化的HCl 与消耗的HCl物质的量之比为_______。
②装置B内试剂为__________,装置C的作用是_________。
(2)若将装置1与装置2连接制备少量氯化铁固体(氯化铁易吸水,在300℃时升华),则:
①D中发生反应的化学方程式为______________;
②D、E间导管短且粗的原因是______________;
③若在D装置的硬质玻璃管内装入硅藻土和碳粉,则发生如下反应:
SiO2+2C+2Cl2![]() SiCl4+2CO
SiCl4+2CO
当反应消耗6g碳时,反应转移的电子数为______,F装置之后还应添加一个装置用来_______。
(3)将装置1与装置3连接来探究氯气是否具有漂白性。
①将氯气依次通过盛有干燥红色布条的广口瓶和盛有湿润红色布条的广口瓶,可观察到的现象是________________。
②为防止氯气尾气污染空气,根据氯水显酸性的性质,可用氢氧化钠溶液吸收多余的氯气,原理是(用离子方程式表示___________。根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是_________(填化学式),长期露置于空气中的失效漂白粉,加稀盐酸后产生的气体是________(用字母代号填)。
A.O2 B.H2 C.CO2 D.HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的组合是( ) 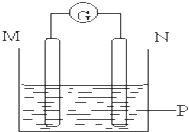
M | N | P | |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关惰性电极电解AgNO3溶液一段时间后的说法,正确的是( )
A.电解过程中阴极质量不变
B.电解过程中溶液的pH不断升高
C.此时向溶液中加入适量的Ag2O固体可使溶液恢复电解前的状况
D.电解后两极产生的气体体积比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾在饮用水和工业污水处理领域的消费增长较快。实验室可用软锰矿(主要成分为MnO2)为原料制备高锰酸钾。其部分流程如下:
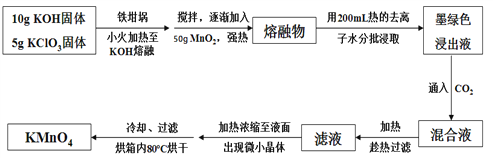
已知:墨绿色浸出液的成分为K2MnO4、KCl溶液
回答下列问题:
(1)实验中采用铁坩埚而不是瓷坩埚的原因是:(用化学反应方程式表示)___________________________________________________。
(2)写出生成K2MnO4和KCl反应的化学方程式:________________________;通入CO2,可使MnO42-发生反应,生成MnO![]() 及MnO2。若通入CO2太多,则在加热浓缩时,会有__________________晶体和KMnO4晶体一起析出。
及MnO2。若通入CO2太多,则在加热浓缩时,会有__________________晶体和KMnO4晶体一起析出。
(3)在加热、浓缩、烘干的过程中温度不宜过高,其原因是(用化学反应方程式表示)_________________________;过滤用到的玻璃仪器有烧杯、_________、_______;加热时用玻璃棒不断搅拌溶液的目的是_______________________________________;洗涤KMnO4晶体用冷水洗涤较好的原因是_______________________________________。
(4)计算12.25 g KClO3固体经过上述转化,最多可制得KMnO4的质量为___________(结果保留一位小数)。(相对原子质量:K—39 Cl—35.5 O—16 Mn—55)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com