
已知键能N≡N 946 kJ/mol ,H-H 436kJ/mol ,N-H 391 kJ/mol.从理论上计算2NH3(g)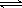 N2(g)+3H2(g)的⊿H为
N2(g)+3H2(g)的⊿H为
A.-46 kJ/mol B.-92 kJ/mol
C.+92 kJ/mol D.+1800kJ/mol
科目:高中化学 来源:2014-2015江苏省宿迁市三校高一下学期4月月考化学试卷(解析版) 题型:选择题
下列除去杂质的操作方法正确的是
A.NO中有少量的NO2:用水洗涤后再干燥
B.食盐中有少量的NH4Cl:加过量的烧碱溶液后加热蒸干
C. N2中有少量的O2:通过足量灼热的氧化铜
D.硝酸中溶有少量NO2,可向硝酸中加入少量水,使NO2与水反应生成硝酸。
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省四地六校高一下学期第一次联考化学试卷(解析版) 题型:填空题
(14分)使用如图所示装置进行化学小实验,请填写下列空白:
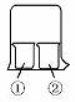
(1)若①中放一片湿润的红色石蕊试纸,②装有浓氨水,可观察到的实验现象为 。
(2)若①装有AlCl3溶液,②装有浓氨水,可观察到的实验现象为 ,反应的离子方程式为 。
(3)若①装有浓硝酸,②装有浓氨水,可观察到的实验现象为 ,反应的化学方程式为 。
(4)若①装有浓硝酸,②装有Na2SO3溶液,实验时有无色气体产生,该气体逐渐变为红棕色,用化学方程式表示无色气体变为红棕色的原因 ,写出浓硝酸和Na2SO3溶液反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省四地六校高一下学期第一次联考化学试卷(解析版) 题型:选择题
下列情况会对人体造成较大伤害的是
A.用SO2漂白银耳
B.自来水中通入少量氯气消毒杀菌
C.用食醋清洗热水瓶胆内壁附着的水垢(水垢的主要成分为CaCO3、Mg(OH)2)
D.用小苏打(NaHCO3)发酵面粉制作馒头
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(解析版) 题型:填空题
(15分)
(1)①比较0.1mol/L的下列各种溶液的pH大小:CH3COONa_______NaClO;(填“>”、“<”或“=”)
②请按顺序排列出1mol/L (NH4)2SO4溶液中各种离子浓度大小关系______________。
③25℃时,如果取0.2mol/LHA溶液与0.2mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=10。混合溶液中由水电离出的c(H+)________0.1mol/LNaOH溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
(2)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式________________
(3)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)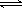 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①该反应的化学平衡常数表达式为K= 。
②该反应为 反应(选填吸热、放热)。
③能判断该反应是否达到化学平衡状态的依据是 。
(A)容器中压强不变 (B)混合气体中 [CO]不变
(C)v正(H2)=v逆(H2O) (D)C(CO2)=C(CO)
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(解析版) 题型:选择题
中学化学中很多“规律”都有其使用范围,下列根据有关“规律”推出的结论合理的是
A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大
B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7
C.根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性
D.根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(解析版) 题型:选择题
下列有关叙述中正确的是
A.因为s轨道的形状是球形的,所以s电子做的是圆周运动
B.3px、3py、3pz的差异之处在于三者中电子(基态)的能量不同
C.原子轨道和电子云都是用来形象地描述电子运动状态的
D.电子云图上的每一个点都代表一个电子
查看答案和解析>>
科目:高中化学 来源:2014-2015云南省高一3月月考化学试卷(解析版) 题型:选择题
物质在相互反应时
A.它们的质量一定相等
B.它们的物质的量一定相等
C.它们的质量比等于方程式中化学计量数之比
D.它们物质的量比等于方程式中化学计量数之比
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市海淀区高三一模理综化学试卷(解析版) 题型:实验题
(12分)硼泥主要由MgO和SiO2组成,含有少量Fe2O3、FeO、Al2O3等杂质。用硼泥生产氢氧化镁的工艺流程如下图所示:

已知某些氢氧化物沉淀的pH如下表所示:
氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
Mg(OH)2 | 9.3 | 10.8 |
Fe(OH)2 | 7.6 | 9.6 |
Fe(OH)3 Al(OH)3 | 2.7 3.7 | 3.7 4.7 |
(1)MgO的电子式为 。
(2)滤渣2的主要成分是 ,向滤渣2中继续加入过量的NaOH溶液,发生反应的离子方程式为 。
(3)加入NaOH调节溶液pH=12.0时,发生反应的离子方程式为 。
(4)利用Mg(OH)2与含SO2的烟气反应生成MgSO4,可以使烟气脱硫,该反应的化学方程式为 。
(5)若取a吨硼泥为原料,最后得到b吨Mg(OH)2产品(假设生产过程中镁元素无损失),则硼泥中MgO的质量分数为 (用含有a、b的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com